Plasma traité au solvant-détergent (Octaplasma)
Auteurs : Shuoyan Ning, M.D., FRCPC, DRCPSC; Isabelle Blais-Normandin, M.D., FRCPC; Bryan Tordon, M.D., FRCPC; Johnathan Mack, M.D., MSc, FRCPC; et Kathryn Webert, M.D., FRCPC
Principaux publics cibles : médecins spécialistes en transfusion, médecins non spécialistes en transfusion, personnel infirmier, technologues de laboratoire travaillant dans un laboratoire d’hôpital
REMARQUE : Veuillez consulter aussi notre FAQ : plasma traité au solvant-détergent (Octaplasma).
Introduction
Cette publication fournit de l’information sur Octaplasma — un plasma humain spécifique à chaque groupe sanguin, destiné à la transfusion et dont les agents pathogènes ont été inactivés — tirée de la monographie du produit et des données que procure la littérature. Octaplasma est fabriqué par Octapharma à partir d’un mélange de plasma humain traité au solvant-détergent et est actuellement homologué au Canada. En 2011, Octaplasma a été approuvé pour utilisation chez certains patients.1 Depuis le 27 mars 2023, Octaplasma peut être utilisé au quotidien chez tous les patients adultes et pédiatriques nécessitant une transfusion de plasma. Cette transition vers un approvisionnement majoritairement constitué de plasma à teneur réduite en agents pathogènes vise à offrir une sécurité supplémentaire aux patients canadiens.
Fabrication d’Octaplasma et description du produit
Fabrication
Octaplasma est une préparation à base d’un mélange de plasma humain dont on a inactivé les agents pathogènes par un traitement au solvant-détergent. Dans le cadre de ce traitement, on décongèle et on met en commun les dons de plasma de 630 à 1 520 personnes ayant le même groupe sanguin ABO (A, B, AB ou O).
Le processus d’inactivation des agents pathogènes utilisé pour le traitement au solvant-détergent diffère de la procédure qu’applique la Société canadienne du sang pour fabriquer des composants de plaquettes à teneur réduite en agents pathogènes (pour en savoir plus sur les plaquettes à teneur réduite en agents pathogènes, voir le chapitre 19 du Guide de la pratique transfusionnelle). Le traitement au solvant-détergent auquel est soumis le plasma rend inactifs les virus à enveloppe lipidique comme le virus de l’immunodéficience humaine (VIH), le virus de l’hépatite B (VHB) et le virus de l’hépatite C (VHC). D’autres virus à enveloppe (p. ex. le virus du Nil occidental, la fièvre chikungunya, les souches grippales) sont également sensibles au traitement.2
Octapharma applique de rigoureux contrôles en ce qui concerne la sélection des donneurs et le dépistage des virus des hépatites B et C et du VIH. Les mélanges de plasma sont analysés pour détecter l’antigène de surface de l’hépatite B et les anticorps anti-VIH 1/2; un test des acides nucléiques est aussi réalisé pour les virus des hépatites A, B, C et E, le VIH et le parvovirus B19 avant la fabrication. Le traitement au solvant-détergent ne rend pas inactifs les virus sans enveloppe comme l’hépatite A et le parvovirus B19.3
Après la mise en commun du plasma, le mélange passe par des étapes de filtration qui visent à éliminer les cellules comme les leucocytes et les fragments cellulaires. Les mélanges de plasma sont traités avec des réactifs du solvant et du détergent [tri(n-butyl)-phosphate (TNBP) 1 % et octoxynol 1 %] qui inactivent les virus à enveloppe lipidique. Les réactifs du solvant et du détergent sont éliminés, puis le produit passe par une colonne de résine d’affinité sur laquelle est fixé un ligand qui se lie aux prions. Après la filtration stérile, le produit final est divisé en unités individuelles et entreposé à une température de ‑18 °C ou inférieure (les mêmes conditions d’entreposage que le plasma congelé [non traité]). Octaplasma contient des facteurs de coagulation et d’autres protéines plasmatiques (albumine, immunoglobulines, autres globulines, complément, inhibiteurs de protéase). Veuillez consulter la monographie du produit pour obtenir plus de renseignements.3
Conditionnement et entreposage
Les unités d’Octaplasma sont placées dans des poches stériles en polychlorure de vinyle emballées dans une pellicule de polyamide/polyéthylène. Chaque unité est emballée individuellement dans une boîte en carton. Chaque unité contient 200 ml de plasma traité au solvant-détergent. Le produit se conserve congelé à une température de -18 °C ou inférieure (les mêmes conditions d’entreposage que le plasma congelé [non traité]); dans ces conditions, Octaplasma se conserve jusqu’à 48 mois. Les poches comportent deux orifices de sortie donnant accès au produit. Des unités compatibles avec les groupes sanguins O, A, B et AB sont disponibles. Une fois décongelé, Octaplasma se conserve 5 jours entre 2 et 8 °C ou 8 heures à température ambiante (20-25 °C). Il ne faut pas recongeler du plasma Octaplasma décongelé. Veuillez consulter la monographie du produit pour obtenir plus de renseignements.3
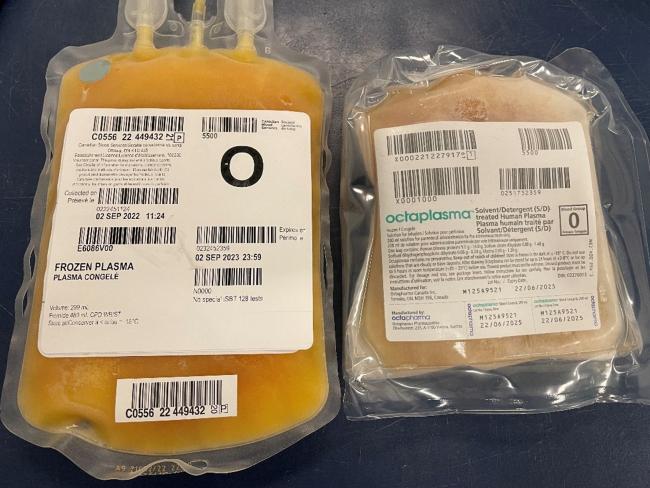
Figure 1. Une unité congelée d’Octaplasma (à droite) à côté d’une unité de plasma congelé non traité (à gauche). Les poches d’Octaplasma sont plus petites et le plastique est plus épais que celles de plasma congelé (non traité). Chaque unité d’Octaplasma a un volume de 200 ml. Veuillez consulter les instructions de décongélation dans la monographie du produit.3
Posologie et caractéristiques du produit
La dose administrée est comparable à celle de plasma congelé non traité (12 à 15 ml d’Octaplasma/kg et 10 à 15 ml de plasma congelé [non traité]/kg). Pour un patient de 70 kg, il faudrait 4 à 5 unités d’Octaplasma pour faire augmenter les taux de facteurs de coagulation de 25 % environ. Veuillez consulter la monographie du produit pour obtenir plus de renseignements.3
Octaplasma contient des protéines plasmatiques humaines, du citrate de sodium dihydraté, du dihydrogénophosphate de sodium dihydraté et de la glycine. La concentration totale de protéines plasmatiques humaines se situe entre 45 et 70 mg/ml. Des études in vitro ont montré une légère réduction (10-20 %) de certains facteurs de coagulation et de l’activité des inhibiteurs de coagulation dans le plasma traité au solvant-détergent par rapport au plasma congelé non traité.2,4,5 Il est avéré que tous les systèmes d’inactivation des pathogènes entraînent une certaine réduction de la coagulation et des activités des inhibiteurs6, avec des réductions notables des facteurs V et VIII pour tous les systèmes.7 Toutefois, il convient de noter que tous les taux de facteurs de coagulation dans Octaplasma restent dans les fourchettes normales attendues pour du plasma congelé (non traité) et les études ne semblent pas indiquer une pertinence clinique des réductions mineures des taux de facteurs de coagulation, à l’exception de la protéine S et de l’alpha2-antiplasmine (voir la section sur les inconvénients et les contre-indications ci-dessous), pour lesquelles on constate une réduction significative.
Tous les facteurs de coagulation dans Octaplasma atteignent un minimum de 0,5 UI/ml, et ce, même au sixième jour d’entreposage.3,8,9Tous les lots d’Octaplasma sont testés régulièrement pour détecter le facteur V, le facteur VIII et le facteur XI (spécification > 0,5 UI/ml), ainsi que la protéine C (> 0,7 UI/ml), la protéine S (> 0,3 UI/ml) et l’alpha2-antiplasmine (> 0,2 UI/ml).6
Tableau 1 : Comparaison du taux de protéines plasmatiques d’Octaplasma avec celui du plasma frais congelé
| Paramètres |
Octaplasma (n = 12*) Moyenne (min. - max.) |
Fourchettes de référence Plasma frais congelé (PFC) |
|---|---|---|
| Total de protéines (mg/ml) | 55 (54–57) | 48–64 |
| Albumine (mg/ml) | 32 (30–34) | 28–41 |
| Fibrinogène (mg/ml) | 2,5 (2,4–2,6) | 1,45–3,85 |
| IgG (mg/ml) | 9,65 (9,15–10,10) | 6,60–14,50 |
| IgA (mg/ml) | 2,00 (1,80–2,05) | 0,75–4,20 |
| IgM (mg/ml) | 1,25 (1,20–1,30) | 0,40–3,10 |
| Facteur V (UI/ml) | 0,78 (0,75–0,84) | 0,54–1,45 |
| Facteur VII (UI/ml) | 1,08 (0,90–1,17) | 0,62–1,65 |
| Facteur X (UI/ml) | 0,78 (0,75–0,80) | 0,68–1,48 |
| Facteur XI (UI/ml) | 0,99 (0,91–1,04) | 0,42–1,44 |
| Protéine C (UI/ml) | 0,85 (0,81–0,87) | 0,58–1,64 |
| Protéine S (UI/ml) | 0,64 (0,55–0,71) | 0,56–1,68 |
| Inhibiteur de la plasmine (UI/ml) | 0,23 (0,20–0,27) | 0,72–1,32 |
|
Source : Monographie d’Octaplasma.3 * Analyse de 12 lots consécutifs d’Octaplasma; les valeurs moyennes (minimum-maximum) sont présentées. |
||
Administration
L’administration d’Octaplasma doit respecter la spécificité du groupe sanguin ABO. Comme c’est le cas avec le plasma congelé, des doses fortes ou des débits rapides de perfusion peuvent entraîner une hypervolémie, un œdème pulmonaire et/ou une insuffisance cardiaque. Des débits rapides de perfusion peuvent aussi causer des symptômes imputables à la toxicité du citrate. Pour cette raison, le débit de perfusion doit rester inférieur à 1 ml d’Octaplasma/kg de poids corporel/minute. L’effet toxique du citrate peut être réduit par l’administration de gluconate de calcium en IV par une autre veine. Veuillez consulter la monographie du produit pour obtenir plus de renseignements.3
Utilisation clinique du plasma traité au solvant‑détergent
En 2011, il a commencé à être possible d’utiliser du plasma traité au solvant-détergent pour certains patients qui ont besoin de transfusions de plasma chroniques ou en d’importants volumes (purpura thrombopénique thrombotique [PTT] congénital, plasmaphérèse nécessitant du plasma comme liquide de substitution, déficits en facteurs de coagulation pour lesquels les concentrés homologués ne sont pas facilement accessibles), ou qui ont des réactions allergiques récurrentes ou des troubles pulmonaires avérés avec un risque accru de syndrome respiratoire aigu post-transfusionnel (TRALI). Il est également devenu possible d’administrer du plasma traité au solvant-détergent aux patients qui n’ont pas accès à du plasma compatible avec leur groupe sanguin, ainsi qu’aux patients ayant des antécédents de réaction potentiellement mortelle au plasma.1,10
Octaplasma est administré à certaines catégories de patients au Canada depuis 2011. Le 27 mars 2023, les restrictions imposées sur les commandes d’Octaplasma ont été levées et le produit peut désormais être utilisé au quotidien chez tous les patients adultes et pédiatriques nécessitant une transfusion de plasma. Octaplasma est déjà très utilisé en Europe depuis plusieurs dizaines d’années et certains pays (Norvège, Suède, Finlande, Royaume-Uni, Pays-Bas) en ont fait le principal produit plasmatique de transfusion.
Efficacité hémostatique
Il existe peu de données comparant le plasma traité au solvant-détergent au plasma congelé (non traité). Les données disponibles laissent penser que le plasma traité au solvant-détergent est comparable au plasma congelé (non traité) sur le plan de l’efficacité hémostatique. Des études cliniques ont montré que le plasma traité au solvant-détergent améliorait bien les paramètres de coagulation et favorisait l’hémostase clinique chez différentes populations de patients.10-15 En 2016, une revue systématique a trouvé six études contrôlées et randomisées (561 patients au total) comparant l’efficacité et l’innocuité du plasma traité au solvant‑détergent par rapport à d’autres formulations de plasma dans des scénarios cliniques courants (1 pontage coronarien, 3 transplantations de foie, 1 coagulopathie, 1 temps de prothrombine allongé). Aucune différence majeure n’a été constatée sur le plan clinique, mais les études étaient de petite envergure et leurs ressources étaient limitées.11 Parmi les personnes subissant des opérations cardiaques qui présentent des coagulopathies complexes, les paramètres de coagulation et l’hémostase clinique n’étaient pas différents après une transfusion de plasma traité au solvant-détergent par rapport à du plasma congelé — à l’exception d’une teneur réduite en protéine S et d’une baisse de l’activité des inhibiteurs de la plasmine, ce qui était attendu.16 Il convient de noter que les taux de facteurs de coagulation dans les produits plasmatiques provenant d’un seul donneur et les taux de facteurs de coagulation après des perfusions de plasma congelé peuvent varier considérablement.5,17Une étude de cohorte récemment publiée comparant le plasma traité au solvant-détergent et le plasma congelé chez une population hétérogène de patients n’a constaté aucune différence dans les résultats cliniques (besoins ultérieurs en plasma, transfusions d’autres composants sanguins, durée du séjour à l’hôpital, mortalité à l’hôpital) entre les groupes.13 Un essai pilote randomisé comparant Octaplasma au plasma standard (VIPER-OCTA) chez des patients hémorragiques qui subissent une dissection chirurgicale d’urgence de l’aorte a également fait état de résultats hémostatiques positifs.18
En cas de déficit en facteur V, lorsqu’aucun concentré de facteurs de coagulation n’est disponible, des études in vitro ont montré que le plasma traité au solvant-détergent était équivalent au plasma non traité sur le plan de l’amélioration des indicateurs de l’hémostase (EXTEM) par thromboélastométrie rotative (ROTEM) et de l’augmentation du taux de facteur V.19 L’utilisation de plasma traité au solvant-détergent a permis d’atteindre une concentration médiane de facteur V de 25,5 % (25,0-27,3 %), ce qui est comparable à l’augmentation du taux de facteur V lors de l’utilisation de plasma non traité, qui est de 27,0 % (20,0-29,5 %). De petites études de série de cas ont également décrit l’utilisation de plasma traité au solvant-détergent dans le traitement d’autres déficits héréditaires de facteurs de coagulation comme ayant un bon effet clinique.20,21
Patients atteints d’une maladie du foie
Un petit nombre d’essais randomisés et d’études de cohorte ont examiné l’utilisation de plasma traité au solvant-détergent chez des patients atteints de cirrhose et ceux qui subissent une transplantation de foie. Dans le cadre d’un essai randomisé, 48 patients nécessitant du plasma en vue d’une procédure effractive ou d’une transplantation ont reçu au hasard du plasma congelé non traité ou du plasma traité au solvant-détergent.22 n comparaison avec le plasma congelé, il a été observé une amélioration du temps de prothrombine et aucune différence sur le plan de la correction du temps de thromboplastine partielle activée. Aucune complication hémorragique évidente n’a été constatée dans l’un ou l’autre des groupes, et aucun patient n’a eu besoin de transfusion sanguine après la procédure. Deux essais contrôlés randomisés de patients subissant une transplantation hépatique (N = 293 patients au total dans une étude23 et 63 patients au total dans l’autre24) visant à comparer le plasma traité au solvant-détergent au plasma congelé n’ont montré aucune différence sur le plan de la correction de la coagulopathie, de la perte sanguine peropératoire et de l’efficacité clinique générale.23,24Une autre étude menée par Bindi et al., qui utilisait la thromboélastographie pour éclairer la pratique transfusionnelle chez des patients cirrhotiques nécessitant une transplantation, a signalé une réduction considérable du volume de plasma requis dans le groupe ayant reçu du plasma traité au solvant-détergent par rapport à celui ayant reçu du plasma congelé (c.-à-d. 2 617 ± 1 297 ml pour le groupe recevant du plasma congelé contre 1 187 ± 560 ml pour le groupe recevant du plasma traité au solvant-détergent, p <0,0001).24
Purpura thrombopénique thrombotique (PTT), syndrome hémolytique urémique (SHU) avec déficit en facteur H
Aucune donnée randomisée comparant le plasma traité au solvant-détergent au plasma congelé chez des patients atteints de PTT ou d’un SHU n’a été publiée. Sur le plan biochimique, le processus de production du plasma traité au solvant-détergent réduit les multimères de facteur von Willebrand de haut poids moléculaire qui provoquent l’agrégation plaquettaire induite par la contrainte de cisaillement que l’on observe dans le PTT.25,26Le produit traité au solvant‑détergent conserve un taux normal d’ADAMTS13 nécessaire pour le traitement du PTT. Le plasma traité au solvant-détergent conserve également le facteur H1122 — une protéine régulatrice dans la voie alterne d’activation du complément susceptible d’être présente en quantité réduite chez les personnes atteintes du SHU.26
À défaut d’études randomisées, des séries de cas et des études d’observation ont fourni des données sur l’innocuité du plasma traité au solvant-détergent utilisé dans ces contextes.25,27,28Dans une cohorte rétrospective de 50 épisodes de PTT traités au moyen d’un échange plasmatique utilisant du plasma surnageant de cryoprécipité ou du plasma traité au solvant‑détergent, aucune différence n’a été constatée dans le nombre médian d’échanges plasmatiques jusqu’à la rémission et dans le volume de plasma utilisé; il a aussi été observé une réduction des réactions allergiques et des réactions au citrate avec le produit traité au solvant‑détergent.27 Les avantages du plasma traité au solvant-détergent (décrits ci-dessous dans la section sur les avantages), notamment la réduction des risques de réaction allergique et de TRALI, sont des considérations importantes dans ce contexte, étant donné les volumes élevés de plasma requis.
Transfusions intra-utérines et chez les nouveau-nés et les patients pédiatriques
L’innocuité et l’efficacité du plasma traité au solvant-détergent chez les patients pédiatriques ont été évaluées dans le cadre d’études cliniques et à partir des bases de données d’hémovigilance. Deux études ouvertes post-commercialisation de phase IV récemment publiées ont rendu compte de l’utilisation de plasma traité au solvant-détergent chez 50 patients gravement malades (dont 37 patients de moins de 2 ans) atteints d’un trouble hépatique et/ou subissant une intervention chirurgicale majeure29, et 41 patients (d’au moins 2 ans) subissant 102 échanges plasmatiques.30 De façon générale, le plasma traité au solvant-détergent était bien toléré et n’a pas semblé être associé à des complications thrombotiques ou hyper-fibrinolytiques. Une vaste étude d’observation de 419 patients pédiatriques aux soins intensifs (âge médian d’un an) parmi 101 unités de soins intensifs pédiatriques dans 21 pays a également signalé l’absence de préoccupations liées à l’innocuité du plasma traité au solvant-détergent. Cette étude décrivait le rapport international normalisé (RIN) post-transfusion et la mortalité aux soins intensifs, pour lesquels aucune différence n’a été constatée par rapport aux patients ayant reçu des transfusions de plasma congelé non traité.31Des études de cohortes rétrospectives publiées ont également rendu compte de l’innocuité et de l’efficacité à court terme du plasma traité au solvant-détergent chez les patients nouveau-nés et pédiatriques.32-37Les plus jeunes patients ayant reçu du plasma traité au solvant-détergent ont été décrits dans une étude qui comprenait 136 nourrissons extrêmement prématurés âgés de moins de 28 semaines.33 Les indications pour la transfusion de plasma traité au solvant-détergent variaient d’une étude à l’autre; les contextes cliniques décrits étaient vastes et comprenaient des échanges plasmatiques thérapeutiques, la chirurgie cardiaque, les troubles hépatiques, la prévention des hémorragies intracrâniennes et la maladie grave. Les données européennes d’hémovigilance remontant jusqu’aux années 1990 sur le plasma traité au solvant-détergent sont également rassurantes.2
Globalement, les données à court terme laissent penser que le plasma traité au solvant‑détergent est sûr pour les patients nouveau-nés et pédiatriques, mais les données à long terme sont encore peu nombreuses. Aucune étude n’a été publiée au sujet de l’utilisation de plasma traité au solvant-détergent pour des transfusions intra-utérines. Il convient d’évaluer et de peser les avantages et les risques avant d’utiliser le plasma traité au solvant-détergent dans ces situations. Veuillez consulter la monographie du produit pour obtenir plus de renseignements.3
Patientes enceintes
Un nombre limité d’études décrivent le recours au plasma traité au solvant-détergent chez des patientes enceintes. Bien qu’il n’y ait aucune indication d’effet nocif, les données proviennent de petites cohortes d’observation et de séries de cas.32,38-40On ne s’attend à aucun effet nocif dû à la présence de TNBP et d’octoxynol dans le produit d’après les études effectuées chez les animaux. Veuillez consulter la monographie du produit pour obtenir plus de renseignements.3
Avantages
Réduction du risque de transmission de maladies infectieuses par transfusion
Le processus d’inactivation des agents pathogènes réduit les risques de transmission de maladie infectieuse par transfusion. Le traitement au solvant-détergent endommage les membranes lipidiques et protège contre les bactéries à enveloppe lipidique, les parasites protozoaires et les virus tels que le VIH, le VHB, le VHC, le virus du Nil occidental et le virus Zika.11 Le traitement au solvant-détergent n’a aucun effet sur les virus sans enveloppe (comme l’hépatite A et le parvovirus B19), mais la mise en commun du plasma réduit la charge virale potentielle par dilution et fournit des anticorps neutralisants.2,41Des tests des acides nucléiques sont également réalisés pour le virus de l’hépatite A et le parvovirus B19 pour les mélanges de plasma. Le traitement au solvant-détergent comporte une étape de filtration stérile qui permet d’éliminer les leucocytes et les bactéries, ainsi qu’une colonne d’affinité qui élimine les prions — ce qui réduit les risques de transmission de ces derniers.3,42-44
Réduction des risques de réactions transfusionnelles indésirables et de TRALI
Le plasma traité au solvant-détergent est susceptible de réduire les risques de réactions transfusionnelles indésirables et de TRALI par rapport au plasma non traité, ce qui pourrait s’expliquer en partie par la dilution des antigènes, des anticorps et des cytokines présents dans les unités individuelles de plasma.11,45,46Les étapes de filtration de la production de plasma traité au solvant-détergent réduisent les particules bioactives, les fragments cellulaires et les cytokines susceptibles de provoquer des réactions.11
En 2019, un examen scientifique de la pratique clinique réalisé par l’American Association of Blood Banks (AABB) a recensé 15 essais d’observation et 7 essais contrôlés randomisés visant à évaluer l’innocuité du plasma traité au solvant-détergent. Aucune des études n’a constaté un risque accru de réactions transfusionnelles indésirables, et les taux de réaction allergique étaient systématiquement inférieurs avec le plasma traité au solvant-détergent par rapport au plasma non traité.47 En France, une enquête régionale sur dix ans a rapporté un taux de réaction allergique de 4,86/10 000 pour les transfusions de plasma traité au solvant-détergent, par rapport à un taux de 7,14/10 000 pour celles de plasma non traité.48 Les données d’hémovigilance du Royaume-Uni, de Norvège, de France et d’Italie montrent aussi de faibles taux d’effets indésirables11,49-51avec le plasma traité au solvant-détergent. En outre, la dilution des anticorps dirigés contre les antigènes leucocytaires humains (HLA) et contre les antigènes neutrophiles humains (HNA)52 réduit les risques de TRALI après une transfusion de plasma traité au solvant-détergent par rapport à du plasma non traité.47,50Toutefois, de rares cas de TRALI ont été signalés après la transfusion de plasma traité au solvant-détergent.53,54
Taux uniforme de facteurs de coagulation
Par rapport au plasma d’un seul donneur, la normalisation des taux de facteurs de coagulation est bien meilleure dans le plasma traité au solvant-détergent en raison de la mise en commun du plasma.4,8,9,41,42,55-58Le plasma d’un seul donneur contient des taux très variables de facteurs de coagulation (entre 50 % et 200 %). Des études ont montré que les quantités de facteurs de coagulation dans les transfusions de plasma non traité et après ces transfusions pourraient varier considérablement.17,5Tous les lots d’Octaplasma sont testés régulièrement pour y détecter le facteur V, le facteur VIII et le facteur XI (spécification > 0,5 UI/ml), ainsi que la protéine C (> 0,7 UI/ml), la protéine S (> 0,3 UI/ml) et l’alpha2-antiplasmine (> 0,2 UI/ml).3,6 D’un point de vue fonctionnel, il n’y a aucune différence au niveau des corrections du temps de prothrombine et du temps de thromboplastine partielle activée, des changements dans la production de thrombine ou des résultats des tests viscoélastiques au point de service entre ces deux produits.16,17,24,55,59L’efficacité hémostatique du plasma traité au solvant-détergent, décrite plus haut, est considérée comme équivalente à celle du plasma non traité. La normalisation du taux de facteurs de coagulation dans le plasma traité au solvant-détergent pourrait être particulièrement avantageuse pour les patients pédiatriques qui reçoivent de faibles volumes de transfusions de plasma.
Inconvénients et contre-indications
Réduction de la teneur en protéine S et en alpha2‑antiplasmine
La teneur en protéine S et en alpha2-antiplasmine (un inhibiteur de la plasmine) est considérablement plus faible dans le plasma traité au solvant-détergent par rapport au plasma non traité. Le traitement au solvant-détergent cause une inactivation partielle de la protéine S, ce qui réduit son activité.4 Dans une étude, la teneur en protéine S du plasma traité au solvant‑détergent était de 0,41 UI/ml au jour 0 et baissait jusqu’à atteindre 0,18 UI/ml au sixième jour d’entreposage9 (la fourchette est de 0,56 à 1,68 UI/ml dans le plasma congelé); le fabricant exige une teneur en protéine S strictement supérieure à 0,3 UI/ml pour le lancement du produit. En ce qui concerne l’alpha2-antiplasmine, l’activité est d’environ 0,23 UI/ml (la fourchette est de 0,72 à 1,32 UI/ml dans le plasma congelé)3; le fabricant exige une teneur strictement supérieure à 0,2 UI/ml pour le lancement du produit. Par conséquent, un déficit grave en protéine S constitue une contre-indication à l’utilisation de plasma traité au solvant-détergent.2,60 L’incidence clinique d’une teneur réduite en alpha2-antiplasmine n’est pas claire. En outre, aucun saignement persistant n’a été signalé chez les patients ayant des déficits congénitaux ou acquis en inhibiteur de la plasmine qui ont reçu un traitement au plasma traité au solvant-détergent.42 Toutefois, il ne faut pas utiliser Octaplasma pour corriger l’hyperfibrinolyse causée par des déficits particuliers en alpha2-antiplasmine. Veuillez consulter la monographie du produit pour obtenir plus de renseignements.3
Les formulations antérieures de plasma traité au solvant-détergent produites aux États-Unis (1998-2002, par Vitex USA) étaient associées à des saignements et des complications thromboemboliques à la suite d’une transplantation hépatique ou d’une aphérèse visant à traiter un purpura thrombopénique thrombotique, ce qui a entraîné leur retrait du marché américain en 2002. En comparaison avec le plasma traité au solvant-détergent européen, le produit américain présentait de plus faibles teneurs en alpha2-antiplasmine et en protéine S, ainsi que d’autres différences biochimiques. Ces différences de qualité étaient attribuées à des différences de fabrication et contribuaient peut-être aux complications observées avec le produit américain.47,61-64 L’actuelle formulation d’Octaplasma n’a fait l’objet d’aucun signalement l’associant à un risque accru de saignement ou de thrombose.42 Une étude de cohorte examinant l’hyperfibrinolyse et les complications de thrombose dans un centre de transplantation utilisant du plasma traité au solvant-détergent par rapport à des centres utilisant du plasma non traité n’a révélé aucune différence dans ces résultats.65
Autres considérations
Il existe très peu de données à long terme chez les patients pédiatriques et les nouveau-nés ayant reçu des transfusions de plasma traité au solvant-détergent (littérature mentionnée plus haut). Aucune étude n’a été publiée au sujet de l’utilisation de plasma traité au solvant-détergent pour des transfusions intra-utérines. Il existe aussi des études limitées décrivant l’utilisation de plasma traité au solvant-détergent chez des patientes enceintes; toutefois, les données publiées n’indiquent pas d’effets nocifs.
Le plasma traité au solvant-détergent n’est pas considéré comme déficitaire en IgA. Selon la monographie du produit, le plasma Octaplasma est contre-indiqué chez les patients ayant un déficit en IgA et une présence avérée d’anticorps anti-IgA, puisqu’il est susceptible de provoquer des réactions anaphylactiques ou anaphylactoïdes. Il convient également d’éviter d’utiliser du plasma traité au solvant-détergent chez les patients hypersensibles au produit ou à tout ingrédient de sa formulation. Veuillez consulter la monographie du produit pour obtenir plus de renseignements.3
Ressources supplémentaires
FAQ : Plasma traité au solvant-détergent (Octaplasma)
- Cette foire aux questions, créée en collaboration avec Octapharma, se veut une aide pour les hôpitaux qui font la transition vers le plasma à teneur réduite en agents pathogènes et se fonde sur les données disponibles au moment de sa publication.
Octaplasma (plasma traité au solvant-détergent) : synthèse clinique d’une page
-
Le personnel des banques de sang pourra imprimer cette synthèse clinique d’une page et la fournir avec les unités d’Octaplasma envoyées aux fins de transfusion.
37.76 KB
Présentation PowerPoint – Octaplasma (plasma traité au solvant-détergent) : informations cliniques
-
Il est possible de télécharger cette présentation PowerPoint et de l’utiliser dans des présentations. Il donne aux professionnels de la santé une vue d’ensemble sur Octaplasma, notamment ses caractéristiques, son innocuité, ses indications et contre-indications, ainsi que les avantages de la méthode d’inactivation des agents pathogènes.
Présentation PowerPoint – Octaplasma (plasma traité au solvant-détergent) : informations cliniques – version courte
-
Il est possible de télécharger cette présentation PowerPoint et de l’utiliser dans des présentations. Il donne aux professionnels de la santé les informations cliniques sous une forme abrégée qui souligne les points clés concernant Octaplasma.
Présentation PowerPoint – Octaplasma : information destinée aux technologues de laboratoire
-
Il est possible de télécharger cette présentation PowerPoint et de l’utiliser dans des présentations. Il donne aux technologues de laboratoire une vue d’ensemble sur la monographie d’Octaplasma, notamment les points clés sur l’étiquetage, le conditionnement, l’entreposage et la décongélation.
Recommandations du CCN concernant l’utilisation de plasma traité au solvant-détergent au Canada
- Élaboré par le Comité consultatif national sur le sang et les produits sanguins (CCN), ce document présente des recommandations cliniques additionnelles en ce qui concerne les indications, la posologie et l’utilisation de ce produit chez des catégories particulières de patients.
Références
Ning S., Blais-Normandin I., Tordon B., Mack J., Webert K. Plasma traité au solvant-détergent (Octaplasma) [Internet]. Ottawa : Société canadienne du sang; 2023. Consulté le [JJ MM AAAA]. Disponible sur le Web : https://profedu.blood.ca/fr/transfusion/publications/plasma-traite-au-solvant-detergent-octaplasma
References
- Agence canadienne des médicaments et des technologies de la santé. Recommandation sur l’utilisation optimale du plasma traité au solvant-détergent. CADTH Technol Overv 2, e2202 (2012).
-
Hellstern, P. & Solheim, B.G. The Use of Solvent/Detergent Treatment in Pathogen Reduction of Plasma. Transfusion medicine and hemotherapy: offizielles Organ der Deutschen Gesellschaft fur Transfusionsmedizin und Immunhamatologie 38, 65-70 (2011).
-
Octapharma Canada. Monographie d’Octaplasma, 31 octobre 2022. (Octapharma Canada, Toronto, ON, 2022).
-
Beeck, H. & Hellstern, P. In Vitro Characterization of Solvent/Detergent-Treated Human Plasma and of Quarantine Fresh Frozen Plasma. Vox sanguinis 74, 219-223 (1998).
-
Theusinger, O.M., Baulig, W., Seifert, B., et al. Relative concentrations of haemostatic factors and cytokines in solvent/detergent-treated and fresh-frozen plasma. British journal of anaesthesia 106, 505-511 (2011).
-
Green, L., Bolton-Maggs, P., Beattie, C., et al. British Society of Haematology Guidelines on the spectrum of fresh frozen plasma and cryoprecipitate products: their handling and use in various patient groups in the absence of major bleeding. British journal of haematology 181, 54-67 (2018).
-
Atreya, C., Glynn, S., Busch, M., et al. Proceedings of the Food and Drug Administration public workshop on pathogen reduction technologies for blood safety 2018 (Commentary, p. 3026). Transfusion 59, 3002-3025 (2019).
-
Leebeek, F.W., Schipperus, M.R. & van Vliet, H.H. Coagulation factor levels in solvent/detergent-treated plasma. Transfusion 39, 1150-1151 (1999).
-
Buchta, C., Felfernig, M., Höcker, P., et al. Stability of coagulation factors in thawed, solvent/detergent-treated plasma during storage at 4 degrees C for 6 days. Vox sanguinis 87, 182-186 (2004).
-
Comité consultatif national sur le sang et les produits sanguins (CCN). Recommandations du CCN concernant l’utilisation de plasma traité au solvant-détergent au Canada. (Comité consultatif national sur le sang et les produits sanguins, 2023).
-
Marietta, M., Franchini, M., Bindi, M.L., et al. Is solvent/detergent plasma better than standard fresh-frozen plasma? A systematic review and an expert consensus document. Blood Transfus. 14, 277-286 (2016).
-
Cicchetti, A., Berrino, A., Casini, M., et al. Health Technology Assessment of pathogen reduction technologies applied to plasma for clinical use. Blood transfusion = Trasfusione del sangue 14, 287-386 (2016).
-
Racine-Brzostek, S.E., Canver, M.C., DeSimone, R.A., et al. Thawed solvent/detergent-treated plasma demonstrates comparable clinical efficacy to thawed plasma. Transfusion 60, 1940-1949 (2020).
-
Spinella, P.C., Frazier, E., Pidcoke, H.F., et al. All plasma products are not created equal: Characterizing differences between plasma products. The journal of trauma and acute care surgery 78, S18-25 (2015).
-
Agence canadienne des médicaments et des technologies de la santé. Recommandation sur l’utilisation optimale du plasma traité au solvant-détergent dans le rapport de l’ACMTS (Ottawa, ON, 2011).
-
Haubelt, H., Blome, M., Kiessling, A.H., et al. Effects of solvent/detergent-treated plasma and fresh-frozen plasma on haemostasis and fibrinolysis in complex coagulopathy following open-heart surgery. Vox sanguinis 82, 9-14 (2002).
-
Chowdary, P., Saayman, A.G., Paulus, U., et al. Efficacy of standard dose and 30 ml/kg fresh frozen plasma in correcting laboratory parameters of haemostasis in critically ill patients. British journal of haematology 125, 69-73 (2004).
-
Stensballe, J., Ulrich, A.G., Nilsson, J.C., et al. Resuscitation of Endotheliopathy and Bleeding in Thoracic Aortic Dissections: The VIPER-OCTA Randomized Clinical Pilot Trial. Anesthesia and analgesia 127, 920-927 (2018).
-
Cushing, M.M., Asmis, L., Calabia, C., et al. Efficacy of solvent/detergent plasma after storage at 2-8 °C for 5 days in comparison to other plasma products to improve factor V levels in factor V deficient plasma. Transfusion and apheresis science: official journal of the World Apheresis Association: official journal of the European Society for Haemapheresis 55, 114-119 (2016).
-
Inbal, A., Epstein, O., Blickstein, D., et al. Evaluation of solvent/detergent treated plasma in the management of patients with hereditary and acquired coagulation disorders. Blood Coagul Fibrinolysis 4, 599-604 (1993).
-
Santagostino, E., Mancuso, M.E., Morfini, M., et al. Solvent/detergent plasma for prevention of bleeding in recessively inherited coagulation disorders: dosing, pharmacokinetics and clinical efficacy. Haematologica 91, 634-639 (2006).
-
Williamson, L.M., Llewelyn, C.A., Fisher, N.C., et al. A randomized trial of solvent/detergent-treated and standard fresh-frozen plasma in the coagulopathy of liver disease and liver transplantation. Transfusion 39, 1227-1234 (1999).
-
Bartelmaos, T., Chabanel, A., Léger, J., et al. Plasma transfusion in liver transplantation: a randomized, double-blind, multicenter clinical comparison of three virally secured plasmas. Transfusion 53, 1335-1345 (2013).
-
Bindi, M.L., Miccoli, M., Marietta, M., et al. Solvent detergent vs. fresh frozen plasma in cirrhotic patients undergoing liver transplant surgery: a prospective randomized control study. Vox sanguinis 105, 137-143 (2013).
-
Evans, G., Llewelyn, C., Luddington, R., et al. Solvent/detergent fresh frozen plasma as primary treatment of acute thrombotic thrombocytopenic purpura. Clinical and laboratory haematology 21, 119-123 (1999).
-
Yarranton, H., Lawrie, A.S., Purdy, G., et al. Comparison of von Willebrand factor antigen, von Willebrand factor-cleaving protease and protein S in blood components used for treatment of thrombotic thrombocytopenic purpura. Transfusion medicine 14, 39-44 (2004).
-
Scully, M., Longair, I., Flynn, M., et al. Cryosupernatant and solvent detergent fresh-frozen plasma (Octaplas) usage at a single centre in acute thrombotic thrombocytopenic purpura. Vox sanguinis 93, 154-158 (2007).
-
de Wit, Y., Rethans, A., van Mierlo, G., et al. Plasma Exchange Therapy Using Solvent Detergent-Treated Plasma: An Observational Pilot Study on Complement, Neutrophil and Endothelial Cell Activation in a Case Series of Patients Suffering from Atypical Hemolytic Uremic Syndrome. Transfusion Medicine and Hemotherapy 49, 288-297 (2022).
-
Spinella, P.C., Borasino, S. & Alten, J. Solvent/Detergent-Treated Plasma in the Management of Pediatric Patients Who Require Replacement of Multiple Coagulation Factors: An Open-Label, Multicenter, Post-marketing Study. Front Pediatr 8, 572 (2020).
-
Josephson, C.D., Goldstein, S., Askenazi, D., et al. Safety and tolerability of solvent/detergent-treated plasma for pediatric patients requiring therapeutic plasma exchange: An open-label, multicenter, postmarketing study. Transfusion 62, 396-405 (2022).
-
Camazine, M.N., Karam, O., Colvin, R., et al. Outcomes Related to the Use of Frozen Plasma or Pooled Solvent/Detergent-Treated Plasma in Critically Ill Children. Pediatr Crit Care Med 18, e215-e223 (2017).
-
Chekrizova, V. & Murphy, W.G. Solvent-detergent plasma: use in neonatal patients, in adult and paediatric patients with liver disease and in obstetric and gynaecological emergencies. Transfusion medicine 16, 85-91 (2006).
-
Al-Abdi, S., Dabelah, K., Mousa, T., et al. Selective prophylactic solvent-detergent plasma and cryoprecipitate transfusion to prevent intraventricular hemorrhage in extreme preterm infants: A case-historical control. J Neonatal Perinatal Med 11, 241-248 (2018).
-
Witt, V., Pichler, H., Beiglboeck, E., et al. Changes in hemostasis caused by different replacement fluids and outcome in therapeutic plasma exchange in pediatric patients in a retrospective single center study. Transfusion and apheresis science: official journal of the World Apheresis Association: official journal of the European Society for Haemapheresis 56, 59-65 (2017).
-
Kalsi, A.S., Al-Azzawi, O. & Gill, R. Comparison of the Coagulation Effect Achieved by OctaplasLG Versus Fresh Frozen Plasma in Pediatric Cardiac Surgical Patients. Clin Appl Thromb Hemost 24, 1327-1332 (2018).
-
Liumbruno, G.M. & Franchini, M. Solvent/detergent plasma: pharmaceutical characteristics and clinical experience. J Thromb Thrombolysis 39, 118-128 (2015).
-
Hall, S., Randall, K., Cole, R., et al. A paediatric tertiary referral centre experience of OctaplasLG (R). British journal of haematology 161, 66-66 (2013).
-
Scully, M., Thomas, M., Underwood, M., et al. Thrombotic thrombocytopenic purpura and pregnancy: presentation, management, and subsequent pregnancy outcomes. Blood 124, 211-219 (2014).
-
O’Connell, M.P., Eogan, M., Murphy, K.M., et al. Solvent-detergent plasma as replacement therapy in a pregnant patient with factor V deficiency. J Matern Fetal Neonatal Med 16, 69-70 (2004).
-
Verghese, L., Tingi, E., Thachil, J., et al. Management of parturients with Factor XI deficiency-10year case series and review of literature. Eur J Obstet Gynecol Reprod Biol 215, 85-92 (2017).
-
Hellstern, P. & Haubelt, H. Manufacture and composition of fresh frozen plasma and virus-inactivated therapeutic plasma preparations: correlation between composition and therapeutic efficacy. Thrombosis research 107 Suppl 1, S3-8 (2002).
-
Liumbruno, G.M., Marano, G., Grazzini, G., et al. Solvent/detergent-treated plasma: a tale of 30 years of experience. Expert review of hematology 8, 367-374 (2015).
-
Neisser-Svae, A., Bailey, A., Gregori, L., et al. Prion removal effect of a specific affinity ligand introduced into the manufacturing process of the pharmaceutical quality solvent/detergent (S/D)-treated plasma OctaplasLG. Vox sanguinis 97, 226-233 (2009).
-
World Health Organization. WHO Guidelines on viral inactivation and removal procedures intended to assure the viral safety of human blood plasma products, Annex 4, TRS No 924. Vol. 2023 (World Health Organization, 2004).
-
Saadah, N.H., van Hout, F.M.A., Schipperus, M.R., et al. Comparing transfusion reaction rates for various plasma types: a systematic review and meta-analysis/regression. Transfusion 57, 2104-2114 (2017).
-
Henricks, L.M., Huisman, E.J., Lopriore, E., et al. Acute haemolytic transfusion reaction after transfusion of fresh frozen plasma in a neonate-Preventable by using solvent/detergent-treated pooled plasma? Transfusion medicine (2022).
-
Cushing, M.M., Pagano, M.B., Jacobson, J., et al. Pathogen reduced plasma products: a clinical practice scientific review from the AABB. Transfusion 59, 2974-2988 (2019).
-
Bost, V., Odent-Malaure, H., Chavarin, P., et al. A regional haemovigilance retrospective study of four types of therapeutic plasma in a ten-year survey period in France. Vox sanguinis 104, 337-341 (2013).
-
Bolton-Maggs, P.H.B., New, H.V. & Tinegate, H. Use of and reactions to fresh frozen plasma in the UK. ISBT Science Series 11, 133-139 (2016).
-
Flesland, O. A comparison of complication rates based on published haemovigilance data. Intensive care medicine 33 Suppl 1, S17-21 (2007).
-
Steinsvåg, C.T., Espinosa, A. & Flesland, Ø. Eight years with haemovigilance in Norway. What have we learnt? Transfusion and apheresis science: official journal of the World Apheresis Association: official journal of the European Society for Haemapheresis 49, 548-552 (2013).
-
Sachs, U.J., Kauschat, D. & Bein, G. White blood cell-reactive antibodies are undetectable in solvent/detergent plasma. Transfusion 45, 1628-1631 (2005).
-
Klanderman, R.B., Bulle, E.B., Heijnen, J.W.M., et al. Reported transfusion-related acute lung injury associated with solvent/detergent plasma - A case series. Transfusion 62, 594-599 (2022).
-
Klanderman, R.B., van Mourik, N., Eggermont, D., et al. Incidence of transfusion-related acute lung injury temporally associated with solvent/detergent plasma use in the ICU: A retrospective before and after implementation study. Transfusion 62, 1752-1762 (2022).
-
Heger, A., Neisser-Svae, A., Trawnicek, L., et al. Thrombin generation potential and clot-forming capacity of thawed fresh-frozen plasma, plasma frozen within 24 h and solvent/detergent-treated plasma (octaplasLG(®)), during 5-day storage at 1-6°C. Vox sanguinis (2018).
-
Irsch, J., Pinkoski, L., Corash, L., et al. INTERCEPT plasma: comparability with conventional fresh-frozen plasma based on coagulation function--an in vitro analysis. Vox sanguinis 98, 47-55 (2010).
-
Mintz, P.D., Bass, N.M., Petz, L.D., et al. Photochemically treated fresh frozen plasma for transfusion of patients with acquired coagulopathy of liver disease. Blood 107, 3753-3760 (2006).
-
Singh, Y., Sawyer, L.S., Pinkoski, L.S., et al. Photochemical treatment of plasma with amotosalen and long-wavelength ultraviolet light inactivates pathogens while retaining coagulation function. Transfusion 46, 1168-1177 (2006).
-
Lerner, R.G., Nelson, J., Sorcia, E., et al. Evaluation of solvent/detergent-treated plasma in patients with a prolonged prothrombin time. Vox sanguinis 79, 161-167 (2000).
-
Hellstern, P. Solvent/detergent-treated plasma: composition, efficacy, and safety. Current opinion in hematology 11, 346-350 (2004).
-
Neisser-Svae, A. & Heger, A. Two solvent/detergent-treated plasma products with a different biochemical profile. ISBT Science Series 11, 94-101 (2016).
-
Yarranton, H., Cohen, H., Pavord, S.R., et al. Venous thromboembolism associated with the management of acute thrombotic thrombocytopenic purpura. British journal of haematology 121, 778-785 (2003).
-
Salge-Bartels, U., Breitner-Ruddock, S., Hunfeld, A., et al. Are quality differences responsible for different adverse reactions reported for SD-plasma from USA and Europe? Transfusion medicine 16, 266-275 (2006).
-
Flamholz, R., Jeon, H.R., Baron, J.M., et al. Study of three patients with thrombotic thrombocytopenic purpura exchanged with solvent/detergent-treated plasma: is its decreased protein S activity clinically related to their development of deep venous thromboses? Journal of clinical apheresis 15, 169-172 (2000).
-
Haugaa, H., Taraldsrud, E., Nyrerød, H.C., et al. Low incidence of hyperfibrinolysis and thromboembolism in 195 primary liver transplantations transfused with solvent/detergent-treated plasma. Clin Med Res 12, 27-32 (2014).