Chapitre 3
Albumine
Auteures : Nicole Relke, M.D., FRCPC et Jeannie Callum, M.D., FRCPC
Date de la dernière révision : September 5, 2025
Contexte
L’albumine est la protéine la plus abondante dans le plasma. Elle est synthétisée dans le foie à un taux d’environ 16 grammes par jour chez l’adulte en bonne santé. Plusieurs hormones peuvent accroître la capacité du corps humain à produire de l’albumine, mais divers facteurs peuvent en réduire la production, notamment la malnutrition, les interventions chirurgicales, l’inflammation, les médicaments et le vieillissement. Une perte de sang de 500 ml entraîne une perte d’albumine sérique de 12 g. Ainsi, dans le contexte d’une hémorragie de l’ordre de quatre unités (environ la moitié du volume sanguin d’un adulte), l’albumine perdue sera entièrement remplacée par la synthèse physiologique en trois jours.
Environ 80 % de la pression oncotique totale du plasma (aussi appelée pression oncotique colloïde) est attribuable à l’albumine sérique. Cette pression est importante pour maintenir des niveaux d’eau appropriés dans le système circulatoire. L’albumine à 5 % et le plasma humain sont iso-osmotiques; en revanche, l’albumine à 25 % est hyperoncotique par rapport au plasma et équivaut à un volume plasmatique d’environ quatre à cinq fois supérieur au volume perfusé. L’augmentation du volume intravasculaire chez un patient présentant un volume sanguin suffisant se produit dans les 20 minutes suivant la perfusion de l’albumine à 25 % (p. ex. en théorie, la perfusion de 100 ml d’albumine à 25 % augmente rapidement le volume intravasculaire à 450 ml).
Description des produits
L’albumine humaine est préparée à partir de dons de plasma humain au moyen du processus de fractionnement de Cohn à l’éthanol froid. Un traitement thermique est utilisé pour la réduction des agents viraux et pathogènes. Toutefois, pour les virus non enveloppés comme le virus de l’hépatite A (VHA) ou le parvovirus B19 par exemple, cela peut n’offrir qu’une protection partielle. La plupart des laboratoires de fractionnement utilisent le test d’amplification des acides nucléiques pour le dépistage du parvovirus B19 et du VHA dans les mélanges de plasma, les unités positives étant retirées du procédé de fabrication. Voir le chapitre 7 du Guide de la pratique transfusionnelle pour des précisions sur les produits de fractionnement.
Lorsque le flacon en verre est intact, l’albumine se présente sous forme de solution stérile sans latex avec un pH physiologique et une concentration de sodium définie. Le produit renferme des stabilisateurs, mais aucun agent de conservation. Les solutions d’albumine normales sont des liquides clairs légèrement visqueux qui peuvent être presque incolores ou encore avoir une couleur jaune, ambre ou vert pâle (voir la figure 1). On trouvera au tableau 1 la liste des préparations à base d’albumine offertes par la Société canadienne du sang.
Figure 1. Flacons d’albumine de différentes couleurs : incolore, jaune, ambre ou vert pâle†
†Remerciements particuliers à la Dre Kathryn Webert et au Dr Charles Musuka pour avoir fourni les photos des flacons d’albumine sur lesquelles se base cette illustration.
Tableau 1 : Préparations à base d’albumine offertes par la Société canadienne du sang†
| Nom du produit | Taille du flacon | Fournisseur; site de production, source du plasma |
Stockage | Stabilisateurs et substances tampons | Teneur en sodium (Na) |
|---|---|---|---|---|---|
| Plasbumin 5 % | 50 ml | Grifols; États-Unis pour la fabrication et le recueil de plasma |
De 2 à 30 °C | Caprylate de sodium, acétyltryptophanate |
130-160 méq/l |
| Albumine 5 % | 500 ml | ||||
| Albumine 25 % | 100 ml | ||||
| Alburex 5 % | 250 ml, 500 ml | CSL Behring; fabrication en Suisse ou aux États-Unis à partir de dons de plasma au Canada ou aux États-Unis | De 2 à 30 °C | Caprylate de sodium, N-acétyltryptophanate de sodium | 140 méq/l |
| Alburex 25 % | 50 ml, 100 ml |
†Pour des mises à jour régulières, veuillez consulter le tableau complet des protéines plasmatiques à l’adresse : https://formulary.blood.ca/fr.
Efficacité de l’albumine
Le recours à l’albumine sert un large éventail de situations cliniques, mais dépend fortement des médecins et des régions. En 2024, l’International Collaboration for Transfusion Medicine Guidelines (ICTMG) a publié des recommandations basées sur des données probantes concernant l’utilisation de l’albumine par voie intraveineuse dans la pratique clinique1. Sur les 14 recommandations, 12 ne préconisent pas l’utilisation de l’albumine dans les diverses situations cliniques où elle est administrée.
Patients gravement malades
Chez les patients gravement malades, la recherche a révélé des résultats similaires entre l’albumine intraveineuse et des produits de remplacement et ce, pour un grand nombre de variables importantes (mortalité, insuffisance rénale, durée de l’hospitalisation, notamment). Les liquides de remplacement, nettement moins onéreux et non dérivés de plasma humain, doivent donc être considérés comme le traitement de première intention.
Un vaste essai contrôlé et randomisé, l’essai SAFE (Saline versus Albumin Fluid Evaluation), qui portait sur 6 997 patients nécessitant une réanimation liquidienne dans des unités de soins intensifs, n’a révélé aucune différence dans le taux de mortalité à 28 jours entre l’administration d’albumine à 4 % et celle d’une solution physiologique salée (risque relatif [RR] de 0,99; intervalle de confiance [IC] à 95 % de 0,91 à 1,09). En outre, aucune différence significative n’a été mise en évidence quant au nombre de jours passés à l’unité de soins intensifs, à la durée d’hospitalisation, au nombre de jours de ventilation mécanique ou au nombre de jours de traitement de remplacement rénal2. Des analyses par sous-groupes de l’essai SAFE n’ont pas démontré les avantages de la perfusion d’albumine chez les patients hypoalbuminémiques. Enfin, l’albumine a permis une économie minimale en matière de traitement liquidien pendant les quatre premiers jours de mesure (rapport solution physiologique salée/albumine de 1,38 plutôt que le rapport attendu de 3:1).
D’autres essais contrôlés randomisés menés ultérieurement ont produit des résultats comparables. L’essai CRISTAL (Colloids Versus Crystalloids for the Resuscitation of the Critically Ill), réalisé en 2013, a démontré que l’utilisation de colloïdes (incluant l’albumine) par rapport aux cristalloïdes n’engendrait aucune différence significative au niveau du taux de mortalité à 28 jours (RR de 0,96; IC à 95 % de 0,88 à 1,04) chez les patients atteints d’hypovolémie hospitalisés dans les unités de soins intensifs3. Dans une autre étude, l’étude ALBIOS (Albumin Italian Outcome Sepsis), 1 818 patients présentant une septicémie grave ou un choc septique ont reçu soit de l’albumine à 20 % en complément d’un traitement aux cristalloïdes, soit une solution de crystalloïdes seule. L’ajout d’albumine n’a entraîné aucune amélioration du taux de survie à 28 jours (RR de 1,0; IC à 95 % de 0,85 à 1,05)4. Enfin, une revue systématique de 2019, incluant 55 essais contrôlés randomisés et 26 329 patients, n’a mis en évidence aucune amélioration au niveau de la mortalité entre des crystalloïdes et des colloïdes, dont l’albumine (RR de 1,02; IC à 95 %, de 0,96 à 1,10)5.
Patients recevant un traitement de remplacement rénal
L’albumine administrée par voie intraveineuse n’est pas recommandée pour la prévention ou le traitement de l’hypotension intradialyse ou pour l’amélioration de l’ultrafiltration1. Une revue de Cochrane portant sur un essai contrôlé randomisé comparant l’albumine à une solution physiologique salée ordinaire chez 45 patients ayant des antécédents d’hypotension intradialyse n’a mis en évidence aucune différence dans le traitement de l’hypotension symptomatique pendant la dialyse ou l’objectif d’ultrafiltration atteint (en pourcentage)6. En 2021, un essai croisé portant sur 65 patients hospitalisés nécessitant une hémodialyse avec des taux d’albumine inférieurs à 30 g/l a démontré que l’albumine à 25 % permettait d’améliorer l’hypotension, le niveau le plus bas de la pression systolique intradialyse ainsi que l’ultrafiltration, par rapport à une solution physiologique salée. Néanmoins, les résultats des patients n’ont pas pu être évalués, sachant qu’il s’agissait d’un essai croisé7. Dans un essai de 2021 mené avec des groupes parallèles en aveugle, des patients gravement malades ont été répartis de manière aléatoire pour recevoir de l’albumine à 25 % ou une solution physiologique salée à 0,9 % en perfusion bolus de 100 ml deux fois au cours d’une dialyse lente de bas débit (SLED) d’une durée de 8 heures8. L’essai comptait 60 patients présentant une insuffisance rénale aiguë qui ont subi 271 dialyses SLED dans des unités de soins intensifs. Les personnes randomisées pour recevoir l’albumine ont présenté moins d’hypotension pendant et après les traitements SLED. Aucune différence significative n’a été observée au niveau des volumes d’ultrafiltration.
Étant donné les coûts de l’albumine, le besoin fréquent de traitement (trois fois par semaine) pour une hémodialyse d’entretien et l’absence globale de données probantes venant appuyer sa supériorité, il convient d’envisager des liquides ou des traitements de remplacement (p. ex. midodrine, dialysat à forte concentration de calcium, température plus basse du dialysat, débits personnalisés d’ultrafiltration). Un essai contrôlé randomisé est en cours et compare l’albumine à 20-25 % avec une solution physiologique salée ordinaire chez des patients gravement malades présentant une insuffisance rénale aiguë et nécessitant un traitement de remplacement rénal. L’objectif est de déterminer si l’albumine améliore l’hypotension intradialyse ainsi que l’ultrafiltration (ALTER-AKI, NCT 04705896)9.
Cirrhose
Paracentèse à grand volume
Chez les patients atteints de cirrhose et d’ascite, l’utilisation de l’albumine pour la paracentèse à grand volume (> 5 l) est recommandée pour éviter le dysfonctionnement circulatoire postparacentèse (défini comme une hausse de l’activité de la rénine plasmatique > 50 % de la valeur prétraitement pour atteindre un niveau > 4 ng/ml/h le sixième jour après la paracentèse)1, 10, 11. Une revue systématique de Cochrane datant de 2019 a porté sur l’utilisation d’expanseurs plasmatiques chez des patients atteints de cirrhose subissant une paracentèse à grand volume. Bien que cette revue ait démontré une réduction de l’incidence de dysfonctionnement circulatoire postparacentèse, aucun effet n’a été constaté au niveau du taux de mortalité, de l’insuffisance rénale ou de la récidive d’ascites12.
Péritonite bactérienne spontanée
Chez les patients atteints de cirrhose et de péritonite bactérienne spontanée (PBS), l’albumine est recommandée pour réduire l’insuffisance rénale et la mortalité. Dans deux revues systématiques, cinq essais contrôlés randomisés menés auprès de patients atteints de cirrhose et de PBS recevant des doses variables d’albumine hyperoncotique ont mis en évidence une réduction des taux d’insuffisance rénale et de mortalité avec l’albumine13, 14. Toutefois, ces essais portaient sur de faibles échantillons et le groupe de contrôle n’avait pas de réanimation liquidienne claire1.
Infections extrapéritonéales
L’albumine n’est pas recommandée chez les patients atteints de cirrhose et d’infections extrapéritonéales. Deux revues systématiques d’essais contrôlés randomisés comparant l’ajout d’albumine à des antibiotiques avec des antibiotiques seuls n’ont révélé aucune amélioration sur le plan de la mortalité ou de l’insuffisance rénale et ont mis en évidence un risque accru d'œdème pulmonaire15, 16.
Syndrome hépatorénal de type 1
Dans les deux revues systématiques portant sur le traitement du syndrome hépatorénal, aucun essai contrôlé randomisé ne comparait l’albumine à un placebo ou à l’absence de traitement17, 18. Dans toutes les études, l’albumine était administrée à la fois dans les groupes de traitement et les groupes de contrôle, et divers médicaments (terlipressine, midodrine et octréotide, notamment) étaient évalués, rendant impossible une évaluation de l’albumine et de son impact sur les résultats en cas de syndrome hépatorénal, malgré sa prescription fréquente. Les dernières lignes directrices de l’ICTMG sur l’albumine n’ont donc pu inclure aucune recommandation concernant l’utilisation de l’albumine pour les patients atteints d’une cirrhose et d’un syndrome hépatorénal1, 15, 16
Administration de longue durée de l’albumine
L’ICTMG ne recommande pas une utilisation régulière de l’albumine en ambulatoire pour les personnes souffrant de cirrhose et d’ascite simple malgré un traitement diurétique1. L’essai ANSWER (Albumin for the treatmeNt of aScites in patients With hEpatic ciRrhosis) a réparti de manière aléatoire des patients atteints de cirrhose et d’ascite simple traités par des antagonistes de l'aldostérone et du furosémide pour qu’ils reçoivent soit la norme de soins, soit le même traitement associé à de l’albumine (40 g, deux fois par semaine pendant deux semaines, puis 40 g une fois par semaine)19. Une hausse de la survie globale a été observée dans le groupe recevant l’albumine (survie à 18 mois : 77 % vs 66 %, HR de 0,62; IC à 95 % de 0,40 à 0,95). Néanmoins, on peut reprocher à cette étude que le groupe de contrôle n’a subi aucune évaluation de santé, alors que les patients recevant l’albumine étaient évalués une fois par semaine. Dans un autre essai mené chez des personnes présentant une cirrhose décompensée en attente de greffe du foie, les patients ont été répartis de manière aléatoire pour recevoir la midodrine en association avec de l’albumine (40 g tous les 15 jours) ou un placebo. Aucune différence significative n’a été mise en évidence entre les deux groupes en termes de mortalité ou de probabilité de complications liées à la cirrhose20. Dans cette étude, les deux groupes étaient exposés aux mêmes situations de santé. Un autre essai (PRECIOSA) est actuellement mené dans cette population1, 21.
Chirurgie cardiaque
L’administration d’albumine par voie intraveineuse n’est pas recommandée chez les patients subissant une chirurgie cardiaque pour amorcer le circuit de circulation extracorporelle ou un remplacement volémique du fait du manque d’efficacité et de dommages accrus1. Des essais contrôlés randomisés menés auprès d’une population pédiatrique et adulte subissant une chirurgie cardiovasculaire ont comparé l’albumine à la gélatine, des amidons ou des solutions cristalloïdes pour l’amorçage du circuit de circulation extracorporelle ou l’expansion volémique. Une revue systématique et une méta-analyse de ces essais n’a montré aucune amélioration sur le plan de la mortalité, de l’insuffisance rénale, de la perte de sang, de la durée de séjour en unité de soins intensifs, de la durée d’hospitalisation ou de l’utilisation de composants sanguins22. Après cette revue systématique, deux autres essais de grande envergure ont fait l’objet d’une publication. Le premier a confirmé que l’ajout d’albumine à 4 % à la solution d’amorçage du circuit de circulation extracorporelle n’a pas diminué l’incidence d’insuffisance rénale aiguë associée à l’intervention cardiaque23. Quant au second essai, il a mis en évidence que l’albumine à 20 % ne réduisait pas de manière significative la durée du traitement vasopresseur par rapport à des crystalloïdes24. L’essai ALBICS (Albumin in Cardiac Surgery), le plus vaste mené dans cette population, a comparé l’albumine à 4 % à la solution d’acétate de Ringer pour amorcer le circuit de circulation extracorporelle et le remplacement volémique périopératoire en intraveineuse. Cette étude a mis en évidence des taux significativement plus élevés de saignement, de resternotomie et d’infection dans le groupe recevant l’albumine25.
Les données probantes récentes, publiées après les recommandations de l’ICTMG sur l’albumine, ne viennent pas appuyer l’utilisation régulière d’albumine hypertonique en postopératoire chez des patients subissant une chirurgie cardiaque à haut risque26. L’essai ALBICS AKI a évalué l’albumine à 20 % en contexte postopératoire par rapport à la prise en charge habituelle et son effet sur la survenue d’insuffisance rénale aiguë chez des patients subissant une chirurgie cardiaque à haut risque. Ainsi, un plus grand nombre de patients recevant l’albumine ont présenté une insuffisance rénale aiguë (48,9 % vs. 43,4 %, RR ajusté par strates de 1,12; IC à 95 % de 1,04 à 1,21; p = 0,003)26. En outre, il y a également eu plus de transfusions sanguines dans le groupe sous albumine (37,8 % vs 29,9 %, p = 0,04). Aucune autre différence n’a été observée au niveau des résultats secondaires26.
Sécurité de l’albumine
Il a été démontré que dans certaines populations particulière, l’albumine n’améliorait pas les résultats, mais au contraire pouvaient avoir des effets néfastes. Le tableau 2 détaille ces différentes situations. L’anaphylaxie est un effet indésirable rare de l’albumine27. Au moment de la rédaction du présent chapitre, aucun cas de transmission du virus de l’immunodéficience humaine (VIH), d’hépatites ou d’une autre maladie virale n’a été signalé; cela dit, il existe un risque théorique de transmission d’une variante de la maladie de Creutzfeldt-Jakob28.
Tableau 2. Risques liés à l’albumine par voie intraveineuse29
| Population de patients | Comparaison | Risque(s) dans le groupe sous albumine |
|---|---|---|
| Chirurgie cardiaque | ||
| Chirurgie cardiaque avec circulation extracorporelle25 | Albumine à 4 % vs soluté lactate de Ringer | Risque accru de saignement, resternotomie et infection |
| Chirurgie cardiaque à haut risque, postopératoire26 | Albumine à 20 % vs prise en charge habituelle | Risque accru d’insuffisance rénale aiguë, transfusion sanguine |
| Cirrhose | ||
| Cirrhose décompensée (patients hospitalisés) et albumine < 30 g/l30 | Albumine à 20 % vs norme de soins | Augmentation des effets indésirables graves ou engageant le pronostic vital (œdème pulmonaire, surcharge volémique) |
| Cirrhose et infections extrapéritonéales16 | Albumine à 20 % vs produit de contrôle | Augmentation des œdèmes pulmonaires |
| Patients gravement malades | ||
| Traumatisme crânien29 | Albumine à 4 % vs solution physiologique salée | Augmentation de la mortalité |
Indications
Il convient de consulter les tableaux 3 et 4 pour connaître les indications recommandées pour l’albumine à 25 % et à 5 %, respectivement, administrée par voie intraveineuse.
Tableau 3 : Indications pour les préparations à base d’albumine à 25 %
| Indication | Avantages |
|---|---|
| Cirrhose hépatique | |
| Paracentèse à grand volume (> 5 l) | Prévention de dysfonctionnement circulatoire postparacentèse |
| Péritonite bactérienne spontanée | Réduction du taux d’insuffisance rénale et de mortalité |
| Syndrome hépatorénal de type 1 | Aucune donnée disponible comparant l’albumine à des stratégies de remplacement |
Tableau 4 : Indications pour les préparations à base d’albumine à 5 %
| Indication | Avantages |
|---|---|
| Aphérèse thérapeutique31 | Liquide de remplacement pour l’échange plasmatique (à l’exclusion des patients ayant un purpura thrombopénique thrombotique, une coagulopathie ou des saignements) |
| Blessure thermique > 20 % de la surface corporelle totale† | Peut réduire le volume total de liquides de réanimation et améliorer la quantité d’urine éliminée dans le cadre d’une utilisation dans les 24 premières heures pour la réanimation |
† Les lignes directrices de l’American Burn Association pour la pratique clinique recommandent aux cliniciens d’envisager l’utilisation de l’albumine, notamment chez les patients présentant des brûlures plus étendues.
Il n’y a pas de données solides qui viennent étayer l’utilisation de l’albumine dans les situations suivantes :
- chirurgie cardiaque (amorçage du circuit de circulation extracorporelle ou remplacement volémique, et albumine à 20 % en postopératoire);
- réanimation liquidienne de première intention pour l’hypovolémie;
- ischémie cérébrale;
- hypoalbuminémie;
- association avec des diurétiques pour l’élimination du liquide extravasculaire;
- traitement ou prévention de l’hypotension intradialyse ou de l’ultrafiltration;
- patients atteints de cirrhose et d’infections extrapéritonéales;
- traumatisme crânien.
Contre-indications
L’albumine est contre-indiquée dans les cas suivants :
- Le patient est incapable de tolérer une augmentation rapide du volume sanguin.
- Le patient a des antécédents de réaction allergique grave à l’albumine.
Posologie et mode d’administration
Le volume et le débit de perfusion varient selon le contexte clinique. Toutefois, le taux de perfusion pour les solutions d’albumine à 5 % ne doit pas dépasser 5 ml par minute, tandis que pour les solutions à 25 %, le taux ne doit pas être supérieur à 1 à 2 ml par minute en raison de la nature hyperosmotique de l’albumine. Il est recommandé de surveiller les patients recevant une perfusion d’albumine à 25 % étant donné le risque de surcharge circulatoire et d’œdème pulmonaire. Les doses d’albumine recommandées sont indiquées dans le tableau 5.
Tableau 5 : Doses maximales recommandées† pour les solutions d’albumine à 25 % selon les indications32
| Indication | Dose |
|---|---|
| Cirrhose hépatique | |
| Paracentèse à grand volume (> 5 l) | De 6 à 8 g d’albumine par litre de liquide retiré |
| Péritonite bactérienne spontanée | Jour 1 : 1,5 g/kg Jour 3 : 1 g/kg |
| Syndrome hépatorénal de type 1‡ | Jour 1 : 1 g/kg Jours 2 à 14 : de 25 à 50 g (100 à 200 ml) par jour |
† Il convient d’envisager une adaptation de la dose chez les patients à risque d’hypervolémie.
‡ Administré avec des agents vasoactifs (p. ex. terlipressine)
Le produit est administré au moyen d’un dispositif de perfusion ventilé standard. L’albumine est compatible avec les solutés électrolytiques et glucosés intraveineux habituels, par exemple, la solution physiologique salée, le soluté lactate de Ringer, le PlasmaLyte et le dextrose à 5 %. Elle ne doit toutefois pas être perfusée en même temps qu’une solution contenant de l’alcool ou des hydrolysats protéiques. L’albumine ne peut être diluée dans des solutions hypotoniques comme de l’eau stérilisée aux fins d’injection, puisque cette dilution peut provoquer une hémolyse grave. Le flacon d’albumine doit être jeté s’il n’est pas utilisé dans les quatre heures suivant son ouverture.
Stockage et transport
Le tableau 1 plus haut indique les températures de stockage des différentes préparations à base d’albumine offertes par l’intermédiaire de la Société canadienne du sang. La durée de conservation varie entre deux et cinq ans, selon le procédé de fabrication. Avant d’administrer le produit, on doit vérifier la date de péremption de chaque flacon, qui est toujours inscrite sur l’emballage. Le produit doit être transporté en maintenant la température dans la fourchette précisée dans la notice d’emballage de la marque concernée et en évitant de briser le contenant. La figure 2 présente les situations où le flacon d’albumine ne doit pas être utilisé.
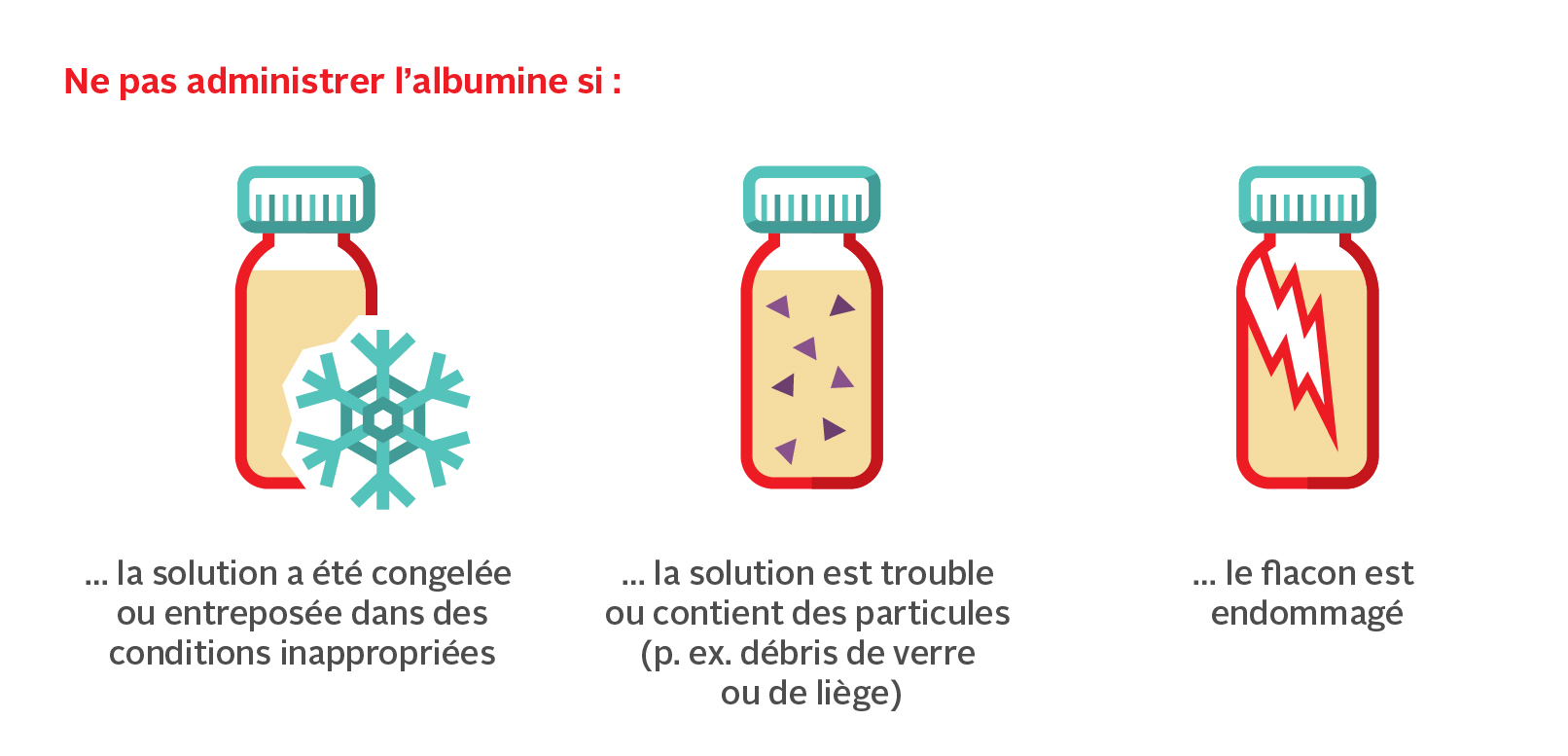
Figure 2. Flacons d’albumine altérés ne devant pas être administrés.
Autres solutions thérapeutiques en remplacement de l’albumine
L’albumine peut être remplacée par :
- des cristalloïdes (solution physiologique salée, soluté lactate de Ringer, p. ex.);
- des colloïdes (solutions d’amidon hydroxyéthylé, p. ex.).
Par rapport à la plupart des colloïdes, les cristalloïdes offrent les avantages suivants : coût moins élevé et plus grande accessibilité. Leurs inconvénients se concrétisent essentiellement lorsque la perfusion d’un volume important s’impose aux fins de réanimation. En effet, les cristalloïdes peuvent alors provoquer un œdème périphérique et pulmonaire.
Bien que d’autres colloïdes comme les solutions d’amidon hydroxyéthylé coûtent moins cher que l’albumine, ils peuvent être associés à des effets secondaires accrus33. En 2013, Santé Canada a publié un avis informant les cliniciens qu’un taux de mortalité accru ainsi qu’une augmentation du risque d’insuffisance rénale et hépatique avaient été associés à l’utilisation de solutions d’amidon hydroxyéthylé et que ces solutions étaient maintenant contre-indiquées chez les patients souffrant de septicémie, de maladie grave du foie ou d’insuffisance rénale accompagnée d’oligurie et d’anurie, non liée à l’hypovolémie34.
Ressources complémentaires
Recommandation de l’ICTMG sur l’utilisation de l’albumine en intraveineuse :
- Callum et al. Use of intravenous albumin: A guideline from the international collaboration for transfusion medicine guidelines. doi: 10.1016/j.chest.2024.02.049
- https://journal.chestnet.org/article/S0012-3692(24)00285-X/fulltext
- Pour d’autres renseignements sur l’utilisation de l’albumine, voir le site Internet de l’ICTMG : https://www.ictmg.org/albumin
- Se référer également à l’article « Use of albumin in critically ill patients published in Chest Physician », Critical Care : https://www.chestphysician.org/use-of-albumin-in-critically-ill-patients/
Crédits de développement professionnel continu
Les associés et les professionnels de la santé qui participent au Programme de maintien du certificat du Collège royal des médecins et chirurgiens du Canada peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue comme activité de développement professionnel continu au titre de la Section 2 – Apprentissage individuel. Ces personnes peuvent réclamer 0,5 crédit par heure de lecture, jusqu’à hauteur de 30 crédits par année.
Les technologistes médicaux qui participent au Programme d’enrichissement professionnel de la Société canadienne de science de laboratoire médical peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue en tant qu’activité non vérifiée.
Remerciements
Les auteures, Nicole Relke et Jeannie Callum, remercient Gwen Clarke, M.D., FRCPC et Matthew Yan, M.D., FRCPC qui ont rédigé la version précédente de ce chapitre.
Si vous avez des questions ou des suggestions d’amélioration concernant le Guide de la pratique transfusionnelle, veuillez communiquer avec nous par l’entremise de notre formulaire.
Suggestion de citation
Relke, N., & Callum, M. (2025), « Chapitre 3 : Albumine » dans A. Khandelwal & K. Brooks (dir.), Guide de la pratique transfusionnelle. Société canadienne du sang. https://professionaleducation.blood.ca/fr/transfusion/guide-clinique/albumine
Si vous avez des questions ou des suggestions d’amélioration concernant le Guide de la pratique transfusionnelle, veuillez communiquer avec nous par l’entremise de notre formulaire.
Références
- Callum, J., Skubas, N. J., Bathla, A., Keshavarz, H., Clark, E. G., Rochwerg, B., Fergusson, D., Arbous, S., Bauer, S. R., China, L., Fung, M., Jug, R., Neill, M., Paine, C., Pavenski, K., Shah, P. S., Robinson, S., Shan, H., Szczepiorkowski, Z. M., . . . Shehata, N. (2024). Use of Intravenous Albumin: A Guideline From the International Collaboration for Transfusion Medicine Guidelines. Chest, 166(2), 321-338. https://doi.org/10.1016/j.chest.2024.02.049
- Finfer, S., Bellomo, R., Boyce, N., French, J., Myburgh, J., & Norton, R. (2004). A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med, 350(22), 2247-2256. https://doi.org/10.1056/NEJMoa040232
- Annane, D., Siami, S., Jaber, S., Martin, C., Elatrous, S., Descorps Declère, A., Preiser, J. C., Outin, H., Troché, G., Charpentier, C., Trouillet, J. L., Kimmoun, A., Forceville, X., Darmon, M., Lesur, O., Reignier, J., Abroug, F., Berger, P., Clec’h, C., . . . for the CRISTAL Investigators. (2013). Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock: The cristal randomized trial. JAMA, 310(17), 1809-1817. https://doi.org/10.1001/jama.2013.280502
- Caironi, P., Tognoni, G., Masson, S., Fumagalli, R., Pesenti, A., Romero, M., Fanizza, C., Caspani, L., Faenza, S., Grasselli, G., Iapichino, G., Antonelli, M., Parrini, V., Fiore, G., Latini, R., & Gattinoni, L. (2014). Albumin replacement in patients with severe sepsis or septic shock. N Engl J Med, 370(15), 1412-1421. https://doi.org/10.1056/NEJMoa1305727
- Martin, G. S., & Bassett, P. (2019). Crystalloids vs. colloids for fluid resuscitation in the Intensive Care Unit: A systematic review and meta-analysis. J Crit Care, 50, 144-154. https://doi.org/10.1016/j.jcrc.2018.11.031
- Fortin, P. M., Bassett, K., & Musini, V. M. (2010). Human albumin for intradialytic hypotension in haemodialysis patients. Cochrane Database Syst Rev(11), Cd006758. https://doi.org/10.1002/14651858.CD006758.pub2
- Macedo, E., Karl, B., Lee, E., & Mehta, R. L. (2021). A randomized trial of albumin infusion to prevent intradialytic hypotension in hospitalized hypoalbuminemic patients. Crit Care, 25(1), 18. https://doi.org/10.1186/s13054-020-03441-0
- Clark, E. G., McIntyre, L., Watpool, I., Kong, J. W. Y., Ramsay, T., Sabri, E., Canney, M., Hundemer, G. L., Brown, P. A., Sood, M. M., & Hiremath, S. (2021). Intravenous albumin for the prevention of hemodynamic instability during sustained low-efficiency dialysis: a randomized controlled feasibility trial (The SAFER-SLED Study). Ann Intensive Care, 11(1), 174. https://doi.org/10.1186/s13613-021-00962-x
- Clark, E. G. (2025). Albumin To Enhance Recovery After Acute Kidney Injury (ALTER-AKI), NCT04705896. National Library of Medicine (NLM). Retrieved 2025-01-12 from https://clinicaltrials.gov/study/NCT04705896?term=ALTER-AKI&intr=albumin&rank=2&a=4
- Biggins, S. W., Angeli, P., Garcia-Tsao, G., Ginès, P., Ling, S. C., Nadim, M. K., Wong, F., & Kim, W. R. (2021). Diagnosis, Evaluation, and Management of Ascites, Spontaneous Bacterial Peritonitis and Hepatorenal Syndrome: 2021 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology, 74(2), 1014-1048. https://doi.org/10.1002/hep.31884
- European Association for the Study of the Liver (EASL). (2018). EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol, 69(2), 406-460. https://doi.org/10.1016/j.jhep.2018.03.024
- Simonetti, R. G., Perricone, G., Nikolova, D., Bjelakovic, G., & Gluud, C. (2019). Plasma expanders for people with cirrhosis and large ascites treated with abdominal paracentesis. Cochrane Database Syst Rev, 6(6), Cd004039. https://doi.org/10.1002/14651858.CD004039.pub2
- Zaccherini, G., Tufoni, M., & Bernardi, M. (2020). Albumin Administration is Efficacious in the Management of Patients with Cirrhosis: A Systematic Review of the Literature. Hepat Med, 12, 153-172. https://doi.org/10.2147/hmer.S264231
- Salerno, F., Navickis, R. J., & Wilkes, M. M. (2013). Albumin infusion improves outcomes of patients with spontaneous bacterial peritonitis: a meta-analysis of randomized trials. Clin Gastroenterol Hepatol, 11(2), 123-130.e121. https://doi.org/10.1016/j.cgh.2012.11.007
- Leão, G. S., John Neto, G., Jotz, R. F., Mattos, A. A., & Mattos Â, Z. (2019). Albumin for cirrhotic patients with extraperitoneal infections: A meta-analysis. J Gastroenterol Hepatol, 34(12), 2071-2076. https://doi.org/10.1111/jgh.14791
- Wong, Y. J., Qiu, T. Y., Tam, Y. C., Mohan, B. P., Gallegos-Orozco, J. F., & Adler, D. G. (2020). Efficacy and Safety of IV albumin for non-spontaneous bacterial peritonitis infection among patients with cirrhosis: A systematic review and meta-analysis. Dig Liver Dis, 52(10), 1137-1142. https://doi.org/10.1016/j.dld.2020.05.047
- Best, L. M., Freeman, S. C., Sutton, A. J., Cooper, N. J., Tng, E. L., Csenar, M., Hawkins, N., Pavlov, C. S., Davidson, B. R., Thorburn, D., Cowlin, M., Milne, E. J., Tsochatzis, E., & Gurusamy, K. S. (2019). Treatment for hepatorenal syndrome in people with decompensated liver cirrhosis: a network meta-analysis. Cochrane Database Syst Rev, 9(9), Cd013103. https://doi.org/10.1002/14651858.CD013103.pub2
- Thomson, M. J., Taylor, A., Sharma, P., Lok, A. S., & Tapper, E. B. (2020). Limited Progress in Hepatorenal Syndrome (HRS) Reversal and Survival 2002-2018: A Systematic Review and Meta-Analysis. Dig Dis Sci, 65(5), 1539-1548. https://doi.org/10.1007/s10620-019-05858-2
- Caraceni, P., Riggio, O., Angeli, P., Alessandria, C., Neri, S., Foschi, F. G., Levantesi, F., Airoldi, A., Boccia, S., Svegliati-Baroni, G., Fagiuoli, S., Romanelli, R. G., Cozzolongo, R., Di Marco, V., Sangiovanni, V., Morisco, F., Toniutto, P., Tortora, A., De Marco, R., . . . Bernardi, M. (2018). Long-term albumin administration in decompensated cirrhosis (ANSWER): an open-label randomised trial. Lancet, 391(10138), 2417-2429. https://doi.org/10.1016/s0140-6736(18)30840-7
- Solà, E., Solé, C., Simón-Talero, M., Martín-Llahí, M., Castellote, J., Garcia-Martínez, R., Moreira, R., Torrens, M., Márquez, F., Fabrellas, N., de Prada, G., Huelin, P., Lopez Benaiges, E., Ventura, M., Manríquez, M., Nazar, A., Ariza, X., Suñé, P., Graupera, I., . . . Ginès, P. (2018). Midodrine and albumin for prevention of complications in patients with cirrhosis awaiting liver transplantation. A randomized placebo-controlled trial. J Hepatol, 69(6), 1250-1259. https://doi.org/10.1016/j.jhep.2018.08.006
- LLC, G. T. (2025). Effects of Long-Term Administration of Human Albumin in Participants With Decompensated Cirrhosis and Ascites (PRECIOSA).
- Skubas, N. J., Callum, J., Bathla, A., Keshavarz, H., Fergusson, D., Wu, B., Stanworth, S., & Shehata, N. (2024). Intravenous albumin in cardiac and vascular surgery: a systematic review and meta-analysis. Br J Anaesth, 132(2), 237-250. https://doi.org/10.1016/j.bja.2023.11.009
- Miralles Bagán, J., Parrilla Quiles, L., Paniagua Iglesias, P., Betbesé Roig, A. J., Sabaté Tenas, S., Pérez García, S., & García Álvarez, M. (2025). The Potential Role of Albumin in Reducing Cardiac Surgery–Associated Acute Kidney Injury: A Randomized Controlled Trial. J Cardiothorac Vasc Anesth, 39(2), 453-460. https://doi.org/10.1053/j.jvca.2024.10.012
- Wigmore, G. J., Deane, A. M., Presneill, J. J., Eastwood, G., Serpa Neto, A., Maiden, M. J., Bihari, S., Baker, R. A., Bennetts, J. S., Ghanpur, R., Anstey, J. R., Raman, J., & Bellomo, R. (2024). Twenty percent human albumin solution fluid bolus administration therapy in patients after cardiac surgery-II: a multicentre randomised controlled trial. Intensive Care Med, 50(7), 1075-1085. https://doi.org/10.1007/s00134-024-07488-3
- Pesonen, E., Vlasov, H., Suojaranta, R., Hiippala, S., Schramko, A., Wilkman, E., Eränen, T., Arvonen, K., Mazanikov, M., Salminen, U.-S., Meinberg, M., Vähäsilta, T., Petäjä, L., Raivio, P., Juvonen, T., & Pettilä, V. (2022). Effect of 4% Albumin Solution vs Ringer Acetate on Major Adverse Events in Patients Undergoing Cardiac Surgery With Cardiopulmonary Bypass: A Randomized Clinical Trial. JAMA, 328(3), 251-258. https://doi.org/10.1001/jama.2022.10461
- Shehabi, Y., Balachandran, M., Al-Bassam, W., Bailey, M., Bellomo, R., Bihari, S., Brown, A., Brown, A., Collins, D., Darlison, P. R., Li, M. A., Mandarano, R., Sarode, V., & Pakavakis, A. (2025). Postoperative 20% Albumin Infusion and Acute Kidney Injury in High-Risk Cardiac Surgery Patients: The ALBICS AKI Randomized Clinical Trial. JAMA Surg. https://doi.org/10.1001/jamasurg.2025.1683
- Shimode, N., Yasuoka, H., Kinoshita, M., Hirashima, K., Tsujimoto, S., Tashiro, C., & Kokubunji, A. (2006). Severe anaphylaxis after albumin infusion in a patient with ahaptoglobinemia. Anesthesiology, 105(2), 425-426. https://doi.org/10.1097/00000542-200608000-00027
- U.S. Food & Drug Administration. (2018). Potential Risk of Variant Creutzfeldt-Jakob Disease (vCJD) From Plasma-Derived Products. https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/potential-risk-variant-creutzfeldt-jakob-disease-vcjd-plasma-derived-products
- Safe Study Investigators, Australian New Zealand Intensive Care Society Clinical Trials Group, Australian Red Cross Blood Service, George Institute for International Health, Myburgh, J., Cooper, D. J., Finfer, S., Bellomo, R., Norton, R., Bishop, N., Kai Lo, S., & Vallance, S. (2007). Saline or albumin for fluid resuscitation in patients with traumatic brain injury. N Engl J Med, 357(9), 874-884. https://doi.org/10.1056/NEJMoa067514
- China, L., Freemantle, N., Forrest, E., Kallis, Y., Ryder, S. D., Wright, G., Portal, A. J., Becares Salles, N., Gilroy, D. W., & O'Brien, A. (2021). A Randomized Trial of Albumin Infusions in Hospitalized Patients with Cirrhosis. N Engl J Med, 384(9), 808-817. https://doi.org/10.1056/NEJMoa2022166
- Oliver, M., & Patriquin, C. (2022). Chapter 14 Therapeutic apheresis (Khandelwal and Abe, Eds.). Canadian Blood Services. https://professionaleducation.blood.ca/en/transfusion/clinical-guide/therapeutic-apheresis
- Sort, P., Navasa, M., Arroyo, V., Aldeguer, X., Planas, R., Ruiz-del-Arbol, L., Castells, L., Vargas, V., Soriano, G., Guevara, M., Gines, P., & Rodes, J. (1999). Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med, 341(6), 403-409. https://doi.org/10.1056/nejm199908053410603
- Reine, P. A., Kongsgaard, U. E., Andersen, A., Thogersen, A. K., & Olsen, H. (2010). Infusions of albumin increase free fraction of naproxen in healthy volunteers: a randomized crossover study. Acta Anaesthesiol Scand, 54(4), 430-434. https://doi.org/10.1111/j.1399-6576.2009.02142.x
- Stange, J., Stiffel, M., Goetze, A., Strube, S., Gruenert, J., Klammt, S., Mitzner, S., Koball, S., Liebe, S., & Reisinger, E. (2011). Industrial stabilizers caprylate and N-acetyltryptophanate reduce the efficacy of albumin in liver patients. Liver Transpl, 17(6), 705-709. https://doi.org/10.1002/lt.22237