Dépistage et prise en charge de la thrombopénie fœtale et néonatale allo-immune
Auteures : Dre Danielle Meunier et Dre Gwen Clarke, FRCPC
Date de publication : Mai 2020
Principaux publics cibles : Technologues de laboratoires médicaux travaillant dans un laboratoire d’hôpital, médecins spécialistes en transfusion
Points clés
- La thrombopénie fœtale et néonatale allo-immune (TFNAI) est une cause de thrombopénie d’origine immune chez les nouveau-nés causée par les anticorps anti-HPA (antigènes plaquettaires humains) de la mère, généralement les anticorps anti-HPA-1a.
- L’hémorragie intracrânienne (HIC) est une complication grave de la TFNAI qui touche 1 naissance vivante sur 10 000.
- L’épreuve diagnostique de la TFNAI se fait en trois étapes principales :
- Dépistage et identification des anticorps anti-HPA maternels;
- Génotypage d’un échantillon du sang de la mère, du père et/ou du nouveau-né pour identifier les gènes HPA;
- Confirmation de la spécificité des anticorps et de leur réactivité à l’aide du test MAIPA (monoclonal antibody immobilization of platelet antigens).
- Si elles sont disponibles immédiatement, il faut transfuser des plaquettes HPA compatibles au nouveau-né souffrant de TFNAI. Si elles ne sont pas disponibles, il faut administrer des unités issues de donneurs aléatoires (pool de plaquettes) en attendant d’obtenir des plaquettes compatibles.
Thrombopénie néonatale
Chez le nouveau-né, la thrombopénie se définit par une numération plaquettaire inférieure à 150 x 109/l et est considérée comme grave si la numération plaquettaire passe en deçà de 50 x 109/l1. La thrombopénie néonatale peut être causée par une diminution de la production de plaquettes (souvent d’origine congénitale), ou, plus couramment, par une destruction ou consommation accrue des plaquettes résultant par exemple d’une septicémie, de la prise de médicaments, d’une entérocolite nécrosante néonatale, d’une coagulation intravasculaire disséminée (CIVD), d’une insuffisance placentaire ou d’une asphyxie. L’augmentation de la consommation de plaquettes peut également être d’origine immune en raison de la TFNAI, ou plus rarement d’un purpura thrombopénique immunologique ou idiopathique maternel2.
Qu’est-ce que la thrombopénie fœtale et néonatale allo-immune?
La thrombopénie fœtale et néonatale allo-immune est une complication rare, mais potentiellement grave, de la grossesse causée par une destruction d’origine immune des plaquettes fœtales par les alloanticorps maternels. Elle peut survenir à chaque fois qu’il y a une incompatibilité entre les plaquettes fœtales et maternelles en raison d’un antigène hérité du père. L’incidence de la TFNAI est estimée entre 1 sur 1 000 et 1 sur 1 500 naissances vivantes. Toutefois, la véritable incidence est probablement plus élevée, car elle n’est souvent pas prise en compte dans les cas de fausse couche ou de mort fœtale intrautérine 3-5. On estime qu’il s’agit de la cause la plus courante de thrombopénie grave chez les nouveau-nés en bonne santé nés à terme6.
Le tableau clinique de la TFNAI est très variable et peut inclure la thrombopénie asymptomatique; un léger saignement prenant la forme de pétéchies, d’hématomes, de petites hémorragies viscérales, d’une hématurie transitoire ou de selles sanguinolentes; ou une hémorragie grave, notamment dans les organes majeurs et le crâne1, 7, 8. Une hémorragie intracrânienne se produit dans 10 à 25 % des cas diagnostiqués de TFNAI, de nombreux cas étant détectés in utero au cours des deuxième et troisième trimestres9. Cette complication de la TFNAI est source de crainte, car elle peut entraîner des déficits neurologiques permanents ou la mort fœtale ou néonatale5.
HPA et TFNAI
Les épitopes d’antigènes plaquettaires humains (HPA) s’expriment sur cinq glycoprotéines clés à la surface membranaire des plaquettes. Trente-sept HPA sont actuellement décrits, dont 22 sont généralement considérés d’intérêt clinique (tableau 1). Les glycoprotéines, dont GPIIIa, GPIb,et GPIa et GPIIa, participent à des fonctions plaquettaires essentielles, comme l’adhésion, l’agrégation et la formation du clou plaquettaire. Les anticorps anti-HPA-1a, un épitope de GPIIIa, sont la cause la plus courante de TFNAI et sont impliqués dans 80 % environ des thrombopénies chez les personnes d’origine caucasienne7, 10, devant les anticorps anti-HPA-5b, anti-HPA-15b et anti-HPA-3a, qui sont responsables de 10 à 15 %, 4 % et 1 à 2 % des cas respectivement. D’autres antigènes HPA sont impliqués à des taux inférieurs à 1 %. Chez les populations asiatiques, les anticorps anti-HPA-5b sont la cause la plus courante de TFNAI, suivis des anticorps anti-HPA-4b11.
L’incidence de la TFNAI causée par les anticorps anti-HPA-1a est illustrée à la figure 1. Bien que les grossesses HPA-1a négatives soient courantes, l’hémorragie intracrânienne due à une TFNAI l’est bien moins.
Tableau 1 : Antigènes HPA spécifiques et leurs glycoprotéines et classe de différenciation (CD) correspondantes. Adapté de Metcalfe, 20046.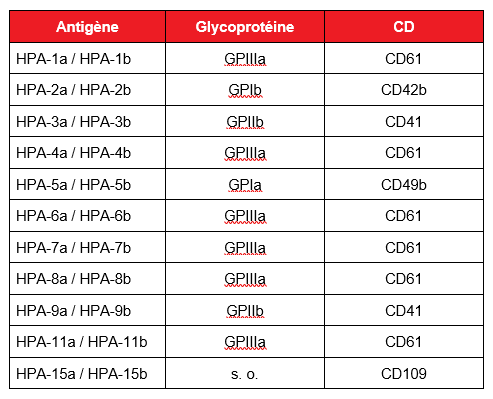
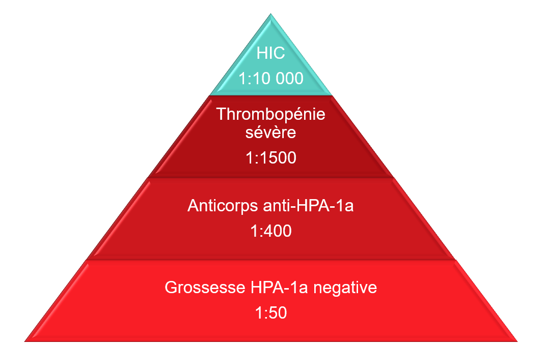
Figure 1 : Épidémiologie de la TFNAI due aux anticorps anti-HPA-1a. Adapté de de Vos et al., 20195. Autorisé en vertu de CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/) / Couleurs modifiées par rapport à l’original.
Physiopathologie de la TFNAI
Le mécanisme de la TFNAI est semblable à celui de la maladie hémolytique du fœtus et du nouveau-né (MHFN). L’exposition maternelle à un HPA incompatible hérité du père sur les plaquettes fœtales provoque une allo-immunisation et la formation d’anticorps anti-HPA chez la mère. Puisqu’il s’agit d’anticorps IgG, ils peuvent facilement traverser le placenta et se fixer aux plaquettes fœtales, qui sont ensuite éliminées de la circulation sanguine par phagocytose. Certains anticorps anti-HPA, dont l’anticorps anti-HPA-1a, peuvent également entraîner une réduction de la production de plaquettes en raison d’une suppression des mégacaryocytes12. Il s’ensuit une thrombopénie fœtale et une augmentation du risque d’hémorragie.
La gravité de la thrombopénie n’est pas toujours corrélée à la gravité des épisodes hémorragiques; de nombreux nouveau-nés souffrant de TFNAI sont gravement thrombopéniques sans hémorragie, tandis que chez d’autres, une thrombopénie modérée peut s’accompagner d’HIC catastrophiques. Sans que cela soit entièrement compris, nous savons que les HPA ne se trouvent pas exclusivement sur les plaquettes. Ils s’expriment aussi sur d’autres tissus, comme l’endothélium 1. Les modèles animaux et les études ex vivo laissent penser que les anticorps anti-HPA maternels provoquent des lésions endothéliales directes13-16. Il a déjà été constaté que l’anticorps anti-HPA-1a en particulier inhibe l’angiogenèse, ce qui réduit la densité des vaisseaux dans le cerveau et les rétines et augmente le risque d’hémorragie dans ces sites14.
Contrairement à la MHFN, l’allo-immunisation de la mère aux HPA tend à se produire au début de la grossesse et la TFNAI touche fréquemment la première grossesse d’une femme allo‑immunisée 5. Bien que les antigènes plaquettaires fœtaux s’expriment dès la seizième semaine de grossesse, l’antigène HPA-1a s’exprime plus tôt encore sur d’autres cellules fœtales, comme les villosités choriales du placenta7, 17. La quantité de HPA-1a sur le placenta au premier trimestre est similaire à la quantité à terme, ce qui laisse penser qu’il s’agit d’une source potentielle d’allo-immunisation maternelle très précoce17. Il existe aussi un lien entre la formation d’anticorps anti-HPA et l’antigène HLA-DRB3*01:0118. Il est rare qu’une femme n’ayant pas ce type de HLA produise des anticorps anti-HPA, et si c’est le cas, la thrombopénie qui en résulte chez son enfant est généralement légère3, 19. Par conséquent, ce test est utile pour sa valeur prédictive négative et peut servir à exclure la possibilité d’une TFNAI grave.
Recherche d’antigènes HPA
Le laboratoire national de référence d’immunologie plaquettaire de la Société canadienne du sang (site Web en anglais) situé à Winnipeg, au Manitoba, effectue le typage HPA et HLA (antigène d’histocompatibilité humain) et le dépistage d’anticorps pour de nombreuses provinces canadiennes. Ces tests sont utilisés cliniquement pour évaluer la TFNAI, ainsi que l’état réfractaire aux plaquettes, le purpura post-transfusionnel et les anomalies de la fonction plaquettaire.
Dépistage des donneurs de plaquettes
Le laboratoire d’immunologie plaquettaire de Winnipeg détermine le typage HPA et HLA de tous les donneurs de plaquettes avant leur inscription au registre national de donneurs de plaquettes. Le typage sérologique des HPA est techniquement difficile, c’est pourquoi on utilise le génotypage HPA pour prédire le phénotype. Le laboratoire utilise la technologie HPA BeadChip de BioArray Solutions (Immucor, Warren, au New Jersey, É.-U.), qui détermine, à l’aide de sondes ciblées, le génotype des 22 antigènes HPA indiqués au tableau 1. La Société canadienne du sang recueille chaque jour des plaquettes par aphérèse auprès de donneurs HPA-1b/1b et conserve un stock national de plaquettes disponibles qui peuvent être utilisées en cas d’urgence chez les nouveau-nés souffrant d’une TFNAI causée par les anticorps anti‑HPA‑1a. L’étiquette finale des unités de plaquettes indique les génotypes HPA sur les plaquettes d’aphérèse spécifiques, ce qui permet de sélectionner rapidement les produits appropriés pour les utiliser chez les patients ayant une TFNAI. Par ailleurs, il est généralement possible de recruter des donneurs ayant d’autres génotypes HPA grâce au registre national aux fins de transfusion de plaquettes à des nouveau-nés dont la TFNAI est causée par d’autres anticorps (comme les anticorps anti-HPA-5b).
Épreuve diagnostique de la TFNAI
On confirme un diagnostic de TFNAI sur la base de l’incompatibilité des HPA de la mère et du nouveau-né ou de la mère et du père, et de la présence d’alloanticorps anti-HPA spécifiques chez la mère2.
Détection des anticorps anti-HPA maternels
La figure 2 présente le bilan diagnostique de la TFNAI, qui commence par la détection des anticorps anti-HPA chez la mère. Pour ce faire, le laboratoire d’immunologie plaquettaire de Winnipeg dispose de deux méthodes. La première est une méthode immunoenzymatique (méthode ELISA) qui utilise des antigènes HPA lyophilisés fixés à un puits. L’ajout de sérum maternel dans le puits entraîne la fixation des anticorps anti-HPA, s’il y en a, et un changement de couleur indique alors leur présence. La deuxième méthode utilise des billes recouvertes d’antigènes HPA. Les anticorps maternels se fixent aux billes et une IgG anti-humaine marquée par fluorescence permet de repérer les billes sur lesquelles se sont fixés des anticorps. On détecte alors la fluorescence à l’aide d’un instrument Luminex (Luminex, Austin, Texas, É.-U.). Il est important de noter que l’immunoglobine intraveineuse (IgIV) interférera avec ces deux méthodes de détection. Dans la mesure du possible, les échantillons doivent être envoyés avant l’administration d’IgIV. Quelle que soit la méthode utilisée, on peut déterminer la présence ou l’absence d’anticorps anti-HPA et identifier par présomption les anticorps en question. Le laboratoire est généralement en mesure de fournir cette information environ trois jours ouvrables après la réception de l’échantillon.

Figure 2 : Bilan diagnostique de la TFNAI au laboratoire d’immunologie plaquettaire de Winnipeg.
*Les durées sont approximatives et indiquées en nombre de jours ouvrables à partir de la réception de l’échantillon
Génotypage HPA
Quels que soient les anticorps anti-HPA présents chez la mère, le génotypage HPA des échantillons maternel, paternel et du nouveau-né est la prochaine étape dans le bilan diagnostique de la TFNAI. Pour ce faire, on utilise la même méthode que celle décrite plus haut pour les donneurs de plaquettes. On peut ainsi déterminer les incompatibilités entre la mère et le père ou le nouveau-né. On obtient les génotypes environ sept jours ouvrables après la réception de l’échantillon.
Test MAIPA
La dernière étape du diagnostic est le test MAIPA. Il s’agit d’un test ELISA modifié qui utilise des anticorps monoclonaux contre les glycoprotéines GPIIb/IIIa et GPIa/IIa pour capturer des antigènes de plaquettes lysées et les immobiliser dans un puits. On détecte alors la présence ou l’absence d’anticorps liés dans le sérum maternel grâce à un changement de couleur, comme dans le cas d’un test ELISA standard6. En fonction des anticorps présents chez la mère et des incompatibilités mère-père/nouveau-né déterminées grâce au génotypage, on analyse un pool de plaquettes ou des plaquettes spécifiques dont on connaît les génotypes HPA en présence de sérum maternel. On peut ainsi confirmer la spécificité d’un anticorps ou détecter une autre réactivité qui n’a peut-être pas été détectée lors du dépistage initial, possiblement en raison d’un anticorps rare. On effectue également un cross-match MAIPA des plaquettes paternelles et du sérum maternel. Le laboratoire d’immunologie plaquettaire produit un rapport final qui comporte tous les résultats du test MAIPA dans les 14 jours environ après la réception de l’échantillon.
Étant donné la nature effractive du prélèvement de sang fœtal, le génotype fœtal n’est généralement pas disponible avant la naissance, ce qui signifie que le diagnostic de TFNAI est provisoire, puisqu’il se fonde sur les échantillons maternel et paternel seulement. Le dépistage prénatal non effractif à l’aide de l’ADN fœtal acellulaire présent dans le plasma maternel n’est possible que pour l’antigène HPA-1a et est envoyé à un laboratoire de référence à l’étranger dans certains cas à haut risque.
Prise en charge de la TFNAI
Le groupe International Collaboration for Transfusion Medicine Guidelines (ICTMG) a récemment publié des recommandations pour la prise en charge de la TFNAI en se fondant sur les données probantes les plus récentes 20. Vous trouverez ci-dessous un résumé des points clés de ce document et d’autres publications.
Traitement prénatal
Comme la plupart des autres pays, le Canada ne dispose pas d’un programme de dépistage systématique des anticorps anti-HPA chez les femmes enceintes. Ainsi, on commence généralement le traitement prénatal chez les femmes dont la précédente grossesse avait été affectée. Étant donné le risque de HIC grave chez les premiers nés, un programme de dépistage efficace nécessiterait une intervention prénatale très précoce. À l’heure actuelle, nous manquons de paramètres cliniques et biologiques fiables pour identifier les fœtus présentant un risque élevé d’hémorragie et une fois que l’hémorragie s’est produite, peu de mesures peuvent être prises pour en atténuer les effets in utero 1, 5. En outre, il n’existe pas pour le moment de traitement permettant d’éviter la production d’anticorps chez les femmes ayant le génotype HPA-1b/1b. De tels traitements préventifs sont toutefois à l’étude 21, 22.
Un traitement prénatal possible consisterait en une transfusion plaquettaire intra-utérine au moyen d’une procédure semblable aux transfusions de globules rouges intra-utérines dans le cas de la MHFN. Pour autant, ce traitement est rarement utilisé en raison du risque élevé de complications (jusqu’à 11 %), notamment la perte fœtale 23. Étant donné le risque d’hémorragie déjà plus élevé chez un fœtus ayant la TFNAI, l’instrumentation du cordon ombilical pourrait s’avérer très dangereuse. Par ailleurs, la demi-vie très courte des plaquettes oblige à effectuer des transfusions hebdomadaires, ce qui pose des limites pratiques et aggrave le risque de complications5.
L’immunoglobine intraveineuse est maintenant considérée comme un traitement prénatal de première intention pour éviter la thrombopénie ou les complications hémorragiques de la TFNAI. Étant donné qu’il est difficile d’effectuer des essais randomisés dans ce domaine, nous manquons de données probantes sur le meilleur dosage et la meilleure période. Le groupe ICTMG laisse entendre qu’il convient de commencer un traitement hebdomadaire d’IVIg chez les femmes à risque élevé entre 12 et 16 semaines de grossesse 5, 20, 23. On ajoute parfois des corticostéroïdes à l’algorithme de traitement, mais il existe peu de données probantes sur leur efficacité 20.
Traitement postnatal
Bien que les données probantes guidant la prise en charge postnatale de la TFNAI soient également limitées, il est généralement admis qu’il faut transfuser des plaquettes sans tarder à un nouveau-né thrombopénique24. La transfusion prophylactique de plaquettes est fortement recommandée pour maintenir le compte de plaquettes au-dessus de 30 x 109/l 20. Bien que ce seuil soit quelque peu arbitraire, Baker et al. ont constaté que la majorité des HIC se produisaient lorsque le compte de plaquettes était inférieur à 30 x 109/l 24. De plus, un essai contrôlé randomisé chez des nourrissons prématurés thrombopéniques a montré qu’un seuil de 50 x 109/l était associé à une mortalité et à un risque d’hémorragie plus élevés qu’un seuil restrictif de 25 x 109/l 25. Si les nouveau-nés ayant une TFNAI ont été exclus de cette étude, de Vos et al. ont toutefois émis l’hypothèse que ces résultats pourraient s’appliquer, du fait de la caractéristique commune entre les nourrissons prématurés et les nouveau-nés ayant une TFNAI, à savoir la fragilité vasculaire5.
Pour les nouveau-nés souffrant d’hémorragies graves, l’ICTMG et d’autres groupes recommandent la transfusion immédiate de plaquettes jusqu’à un seuil de 50 x 109/l pendant au moins sept jours5, 20.
On s’est aussi demandé quel type de produit plaquettaire optimal pouvait être utilisé pour traiter les nouveau-nés ayant la TFNAI : les plaquettes compatibles (plaquettes HPA spécifiques ou plaquettes maternelles), ou les plaquettes aléatoires. Le groupe ICTMG a récemment apporté des clarifications à ce sujet à l’occasion d’un examen systématique par Baker et al. visant à évaluer les données en faveur de la prise en charge postnatale de la TFNAI 24. Le groupe s’est penché sur les données de 754 nouveau-nés ayant la TFNAI, dont 382 ont reçu une transfusion de plaquettes. Parmi les études qui indiquaient une augmentation des plaquettes et/ou qui comparaient les unités compatibles et les unités aléatoires, il a été constaté que les plaquettes compatibles entraînaient une meilleure augmentation post-transfusion et qu’elles avaient une demi-vie plus longue que les unités aléatoires (demi-vie de 1,9 jour contre 1 jour pour les plaquettes aléatoires). Les unités aléatoires offraient tout de même une augmentation suffisante pour obtenir une hémostase. De plus, Winkelhorst et al. ont analysé une cohorte néerlandaise de 102 patients qui venaient de recevoir un diagnostic de TFNAI. Ils ont constaté qu’on obtenait des augmentations similaires du nombre de plaquettes avec les plaquettes HPA spécifiques et un pool de plaquettes 26.
Au vu de ces études, le groupe ICTMG recommande d’administrer des plaquettes HPA spécifiques à titre de prophylaxie et en cas d’hémorragie active chez les nouveau-nés ayant la TFNAI si elles sont disponibles immédiatement 20, 24. Si les unités ne sont pas immédiatement disponibles, il faut transfuser sans tarder des unités aléatoires, soit pendant toute la période du traitement, soit jusqu’à ce qu’un produit compatible soit disponible.
Outre la transfusion plaquettaire et le traitement symptomatique, on utilise parfois l’IgIVg et/ou des corticostéroïdes après la naissance, même si les données probantes sont insuffisantes à l’heure actuelle pour évaluer leurs éventuels bienfaits24.
Immunoprophylaxie
Dans le cas de la MHFN, l’administration d’anti-D (RhIg) aux femmes enceintes D-négatives peut prévenir l’allo-immunisation. L’élaboration d’une méthode similaire visant à éviter la production d’anticorps anti-HPA-1a suscite l’intérêt, et des travaux de recherche sont en cours à cette fin. Un anticorps anti-HPA-1a recombiné a été testé chez les humains et s’est révélé efficace pour ignorer les plaquettes HPA-1a positives 21, 22. Il est également possible d’extraire les anticorps anti-HPA-1a du plasma de donneurs aléatoires en utilisant une méthode similaire à celle utilisée pour la production de RhIg. Alors que de nombreuses questions restent sans réponse en ce qui concerne le dosage optimal, la période et l’efficacité, des essais sont en cours et une immunoprophylaxie pour la TFNAI pourrait être disponible à l’avenir.
Ressources de la Société canadienne du sang
Veuillez consulter les lettres aux clients suivantes de la Société canadienne du sang :
- Lettre aux clients no 2020-01, Ajout des résultats HLA/HPA sur l’étiquette finale des plaquettes d’aphérèse, publiée le 20 janvier 2020
- Lettre aux clients no 2020-10, Ajout des résultats HLA/HPA sur les étiquettes finales des plaquettes d’aphérèse, publiée le 2 mars 2020.
Bibliographie
1. Winkelhorst D, Oepkes D. Foetal and Neonatal Alloimmune Thrombocytopenia. Best Pract Res Clin Obstet Gynaecol 2019; 58: 15-27.
2. Clarke G, Hannon J. Chapitre 12 : La maladie hémolytique du fœtus et du nouveau-né et thrombopénie immune périnatale. Guide de la pratique transfusionnelle. Révisé par Clarke G, Chargé S. Publié à Ottawa par la Société canadienne du sang, 2018. https://profedu.blood.ca/fr/transfusion/clinical-guide/la-maladie-hemolytique-du-foetus-et-du-nouveau-ne-et-thrombopenie-immune.
3. Kjeldsen-Kragh J, Killie MK, Tomter G, Golebiowska E, Randen I, Hauge R, Aune B, Oian P, Dahl LB, Pirhonen J, Lindeman R, Husby H, Haugen G, Gronn M, Skogen B, Husebekk A. A Screening and Intervention Program Aimed to Reduce Mortality and Serious Morbidity Associated with Severe Neonatal Alloimmune Thrombocytopenia. Blood 2007; 110: 833-9.
4. Kamphuis MM, Paridaans N, Porcelijn L, De Haas M, Van Der Schoot CE, Brand A, Bonsel GJ, Oepkes D. Screening in Pregnancy for Fetal or Neonatal Alloimmune Thrombocytopenia: Systematic Review. Bjog 2010; 117: 1335-43.
5. de Vos TW, Winkelhorst D, de Haas M, Lopriore E, Oepkes D. Epidemiology and Management of Fetal and Neonatal Alloimmune Thrombocytopenia. Transfus Apher Sci 2019: 102704.
6. Metcalfe P. Platelet Antigens and Antibody Detection. Vox Sang 2004; 87 Suppl1: 82-6.
7. McQuilten ZK, Wood EM, Savoia H, Cole S. A Review of Pathophysiology and Current Treatment for Neonatal Alloimmune Thrombocytopenia (Nait) and Introducing the Australian Nait Registry. Aust N Z J Obstet Gynaecol 2011; 51: 191-8.
8. Winkelhorst D, Kamphuis MM, de Kloet LC, Zwaginga JJ, Oepkes D, Lopriore E. Severe Bleeding Complications Other Than Intracranial Hemorrhage in Neonatal Alloimmune Thrombocytopenia: A Case Series and Review of the Literature. Transfusion 2016; 56: 1230-5.
9. Tiller H, Kamphuis MM, Flodmark O, Papadogiannakis N, David AL, Sainio S, Koskinen S, Javela K, Wikman AT, Kekomaki R, Kanhai HH, Oepkes D, Husebekk A, Westgren M. Fetal Intracranial Haemorrhages Caused by Fetal and Neonatal Alloimmune Thrombocytopenia: An Observational Cohort Study of 43 Cases from an International Multicentre Registry. BMJ Open 2013; 3.
10. Newman PJ, Derbes RS, Aster RH. The Human Platelet Alloantigens, Pla1 and Pla2, Are Associated with a Leucine33/Proline33 Amino Acid Polymorphism in Membrane Glycoprotein Iiia, and Are Distinguishable by DNA Typing. J Clin Invest 1989; 83: 1778-81.
11. Ohto H, Miura S, Ariga H, Ishii T, Fujimori K, Morita S. The Natural History of Maternal Immunization against Foetal Platelet Alloantigens. Transfus Med 2004; 14: 399-408.
12. Liu ZJ, Bussel JB, Lakkaraja M, Ferrer-Marin F, Ghevaert C, Feldman HA, McFarland JG, Chavda C, Sola-Visner M. Suppression of in Vitro Megakaryopoiesis by Maternal Sera Containing Anti-Hpa-1a Antibodies. Blood 2015; 126: 1234-6.
13. Shivdasani RA, Rosenblatt MF, Zucker-Franklin D, Jackson CW, Hunt P, Saris CJ, Orkin SH. Transcription Factor Nf-E2 Is Required for Platelet Formation Independent of the Actions of Thrombopoietin/Mgdf in Megakaryocyte Development. Cell 1995; 81: 695-704.
14. Yougbare I, Zdravic D, Ni H. Angiogenesis and Bleeding Disorders in Fnait. Oncotarget 2015; 6: 15724-5.
15. van Gils JM, Stutterheim J, van Duijn TJ, Zwaginga JJ, Porcelijn L, de Haas M, Hordijk PL. Hpa-1a Alloantibodies Reduce Endothelial Cell Spreading and Monolayer Integrity. Mol Immunol 2009; 46: 406-15.
16. Santoso S, Wihadmadyatami H, Bakchoul T, Werth S, Al-Fakhri N, Bein G, Kiefel V, Zhu J, Newman PJ, Bayat B, Sachs UJ. Antiendothelial Alphavbeta3 Antibodies Are a Major Cause of Intracranial Bleeding in Fetal/Neonatal Alloimmune Thrombocytopenia. Arterioscler Thromb Vasc Biol 2016; 36: 1517-24.
17. Kumpel BM, Sibley K, Jackson DJ, White G, Soothill PW. Ultrastructural Localization of Glycoprotein Iiia (Gpiiia, Beta 3 Integrin) on Placental Syncytiotrophoblast Microvilli: Implications for Platelet Alloimmunization During Pregnancy. Transfusion 2008; 48: 2077-86.
18. Kjeldsen-Kragh J, Skogen B. Mechanisms and Prevention of Alloimmunization in Pregnancy. Obstet Gynecol Surv 2013; 68: 526-32.
19. Williamson LM, Hackett G, Rennie J, Palmer CR, Maciver C, Hadfield R, Hughes D, Jobson S, Ouwehand WH. The Natural History of Fetomaternal Alloimmunization to the Platelet-Specific Antigen Hpa-1a (Pla1, Zwa) as Determined by Antenatal Screening. Blood 1998; 92: 2280-7.
20. Lieberman L, Greinacher A, Murphy MF, Bussel J, Bakchoul T, Corke S, Kjaer M, Kjeldsen-Kragh J, Bertrand G, Oepkes D, Baker JM, Hume H, Massey E, Kaplan C, Arnold DM, Baidya S, Ryan G, Savoia H, Landry D, Shehata N. Fetal and Neonatal Alloimmune Thrombocytopenia: Recommendations for Evidence-Based Practice, an International Approach. Br J Haematol 2019; 185: 549-62.
21. Ghevaert C, Wilcox DA, Fang J, Armour KL, Clark MR, Ouwehand WH, Williamson LM. Developing Recombinant Hpa-1a-Specific Antibodies with Abrogated Fcgamma Receptor Binding for the Treatment of Fetomaternal Alloimmune Thrombocytopenia. J Clin Invest 2008; 118: 2929-38.
22. Ghevaert C, Herbert N, Hawkins L, Grehan N, Cookson P, Garner SF, Crisp-Hihn A, Lloyd-Evans P, Evans A, Balan K, Ouwehand WH, Armour KL, Clark MR, Williamson LM. Recombinant Hpa-1a Antibody Therapy for Treatment of Fetomaternal Alloimmune Thrombocytopenia: Proof of Principle in Human Volunteers. Blood 2013; 122: 313-20.
23. Winkelhorst D, Murphy MF, Greinacher A, Shehata N, Bakchoul T, Massey E, Baker J, Lieberman L, Tanael S, Hume H, Arnold DM, Baidya S, Bertrand G, Bussel J, Kjaer M, Kaplan C, Kjeldsen-Kragh J, Oepkes D, Ryan G. Antenatal Management in Fetal and Neonatal Alloimmune Thrombocytopenia: A Systematic Review. Blood 2017; 129: 1538-47.
24. Baker JM, Shehata N, Bussel J, Murphy MF, Greinacher A, Bakchoul T, Massey E, Lieberman L, Landry D, Tanael S, Arnold DM, Baidya S, Bertrand G, Kjaer M, Kaplan C, Kjeldsen-Kragh J, Oepkes D, Savoia H, Ryan G, Hume H. Postnatal Intervention for the Treatment of Fnait: A Systematic Review. J Perinatol 2019; 39: 1329-39.
25. Curley A, Stanworth SJ, Willoughby K, Fustolo-Gunnink SF, Venkatesh V, Hudson C, Deary A, Hodge R, Hopkins V, Lopez Santamaria B, Mora A, Llewelyn C, D'Amore A, Khan R, Onland W, Lopriore E, Fijnvandraat K, New H, Clarke P, Watts T. Randomized Trial of Platelet-Transfusion Thresholds in Neonates. N Engl J Med 2019; 380: 242-51.
26. Winkelhorst D, Oostweegel M, Porcelijn L, Middelburg RA, Zwaginga JJ, Oepkes D, van der Bom JG, de Haas M, Lopriore E. Treatment and Outcomes of Fetal/Neonatal Alloimmune Thrombocytopenia: A Nationwide Cohort Study in Newly Detected Cases. Br J Haematol 2019; 184: 1026-9.