Chapitre 12
La maladie hémolytique du fœtus et du nouveau-né et thrombopénie immune périnatale
Contexte
Le présent chapitre porte sur les tests de dépistage et les traitements qui sont pertinents dans le cadre du suivi de la mère et du fœtus pendant la grossesse ainsi que pour le nourrisson, dans le but de réduire le risque de maladie hémolytique du fœtus et du nouveau-né et de thrombopénie immune.
Maladie hémolytique du fœtus et du nouveau-né
Qu’est-ce que la maladie hémolytique du fœtus et du nouveau-né?
La maladie hémolytique du fœtus et du nouveau-né allo-immune peut survenir quand une femme enceinte est porteuse d’un anticorps dirigé contre un antigène hérité du père se trouvant sur les globules rouges fœtaux. De nombreux anticorps dirigés contre des antigènes érythrocytaires peuvent causer la maladie hémolytique du fœtus et du nouveau-né, notamment ceux du système ABO, du système Rhésus et d’autres systèmes de groupes sanguins. Les femmes peuvent développer des anticorps en raison d’une grossesse antérieure ou d’une transfusion. Les anticorps maternels peuvent traverser le placenta pour se lier aux antigènes érythrocytaires du fœtus et déclencher leur destruction ou la suppression de l’érythropoïèse dans la moelle osseuse du fœtus. La maladie hémolytique du fœtus et du nouveau-né peut être asymptomatique ou se manifester par un ictère, de l’anémie et, dans la pire éventualité, elle peut causer la mort du fœtus ou du nouveau-né. On peut déceler le risque de maladie hémolytique du fœtus et du nouveau-né en soumettant la mère à une épreuve de groupage sanguin et de recherche d’anticorps pendant la grossesse. Il est possible de prévenir la maladie hémolytique du fœtus et du nouveau-né due à l’antigène RhD en administrant à la mère de l’anti-D passif afin d’inhiber sa réponse immunitaire aux antigènes RhD du fœtus.
Tests sérologiques systématiques pendant la grossesse
On recommande de soumettre toutes les femmes enceintes à un typage sérologique pour les antigènes ABO et RhD et à des tests de dépistage afin de déceler la présence d’anticorps érythrocytaires inattendus (tableau 1). Ces tests sont effectués à la première visite prénatale. Le test initial de dépistage des anticorps permet de déterminer si les femmes porteuses de l’antigène RhD négatif ont déjà été exposées au RhD (donc sensibilisées) et si elles ont produit des anticorps anti-D. En outre, il permettra de déterminer si les femmes sont porteuses d’autres anticorps érythrocytaires susceptibles de causer la maladie hémolytique du fœtus et du nouveau-né. Entre la 26e et la 28e semaine de grossesse, on fait subir un autre test aux femmes RhD négatif afin de confirmer leur groupe sanguin et de déceler la présence d’anticorps érythrocytaires inattendus avant de leur administrer un traitement préventif par immunoglobulines Rh (IgRh). Toutefois, il ne faut pas renoncer à l’administration d’IgRh en attendant les résultats de ces tests (figure 1; pour avoir des précisions sur le traitement, se reporter aux prochaines sections du chapitre). Quel que soit leur typage Rh, toutes les femmes possédant des antécédents d’anticorps érythrocytaires cliniquement significatifs ou ayant vécu des événements susceptibles de provoquer la formation d’anticorps, comme une transfusion sanguine, des complications de la grossesse, une amniocentèse ou le prélèvement de villosités choriales, pourraient avoir à subir d’autres tests de dépistage de ces anticorps pendant le deuxième et le troisième trimestre de la grossesse. Certaines lignes directrices1, 2 recommandent de répéter les tests de dépistage des anticorps et de confirmation du groupe ABO et du Rh chez toutes les femmes, entre la 26e et la 28e semaine de grossesse, afin de confirmer le groupe ABO et le Rh et d’exclure la possibilité de développement d’anticorps après le test initial (figures 1 et 2).
Tableau 1 : Calendrier des tests sérologiques recommandés durant la grossesse
| Type de grossesse | Moment pendant la grossesse | Test |
|---|---|---|
| Toutes les grossesses | À la première visite prénatale, idéalement pendant le premier trimestre |
|
| Première grossesse, peu importe le type Rh établi au premier test | Entre la 26e et la 28e semaine de grossesse |
|
| Femmes RhD négatif et femmes RhD positif§ | Entre la 26e et la 28e semaine de grossesse, avant l’administration d’IgRh |
|
| Femmes susceptibles d’avoir développé des anticorps érythrocytaires* | À la 28e semaine de grossesse ou après |
|
|
# L’identification des anticorps s’impose quand on décèle leur présence; il faudra prélever un échantillon avant l’injection d’IgRh.
§ Les lignes directrices canadiennes recommandent de réévaluer la présence d’anticorps chez toutes les femmes enceintes entre la 26e et la 28e semaine de grossesse, peu importe leur système Rh. * Il est certainement indiqué de répéter les tests chez les femmes possédant des antécédents d’anticorps érythrocytaires cliniquement significatifs ou ayant vécu des événements susceptibles de provoquer la formation d’anticorps, comme une transfusion sanguine, des complications de la grossesse, une amniocentèse ou le prélèvement de villosités choriales. Certaines lignes directrices recommandent de répéter les tests chez toutes les femmes, peu importe les événements qui accroissent le risque d’allo-immunisation. |
||
| D’après les Guidelines for Prenatal and Perinatal Immunohematology d’AABB3 | ||
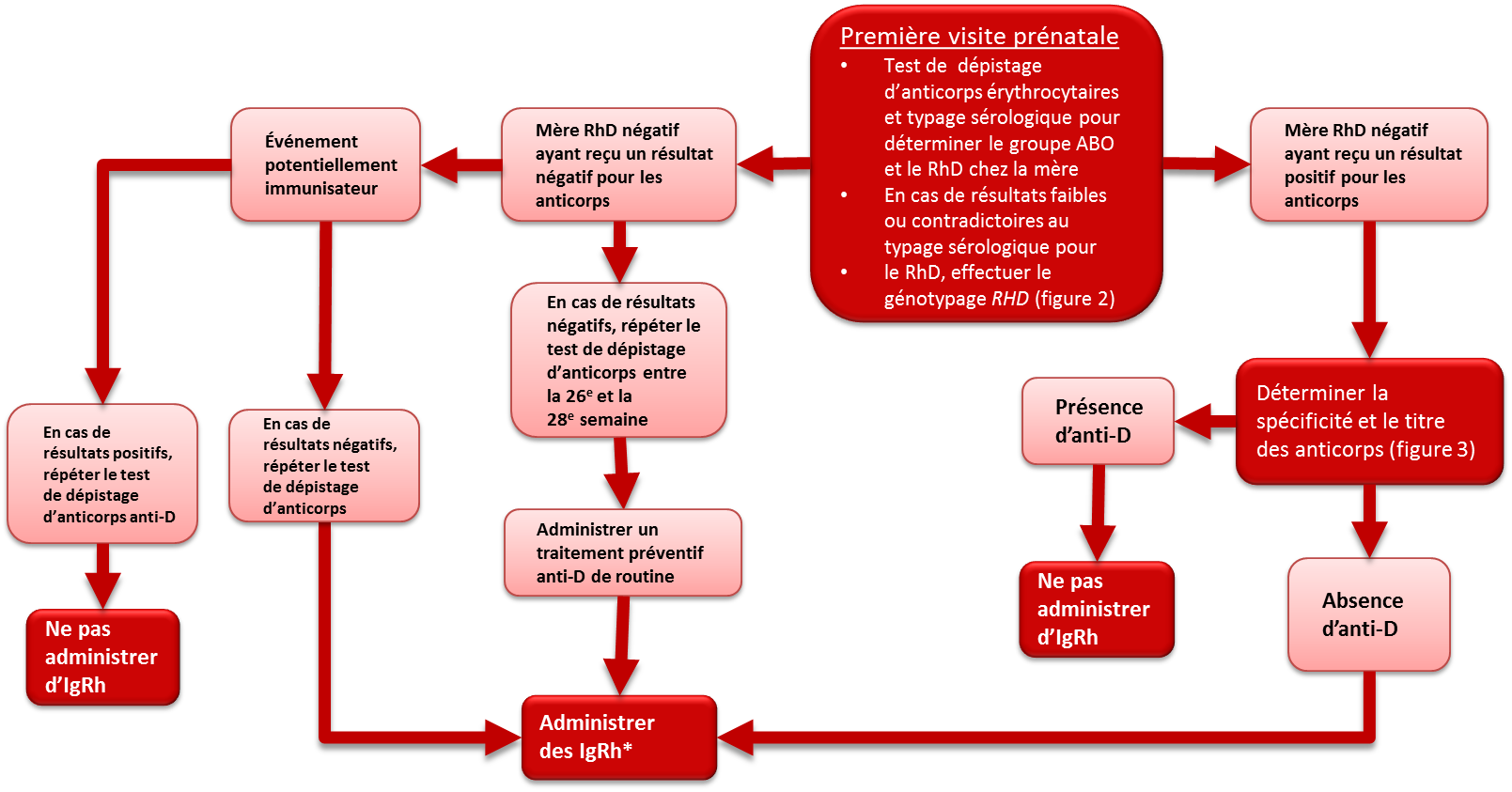
Figure 1. Épreuves sérologiques prénatales chez une mère RhD négatif
*Administrer des IgRh si l’on n’a pas la certitude que la mère est immunisée contre l’antigène D et que le fœtus n’est pas RhD négatif. Répéter l’administration des IgRh à 12 semaines d’intervalle jusqu’à la naissance; posologie selon la notice du produit. Pour les indications et la posologie suggérée, se reporter au tableau 2.
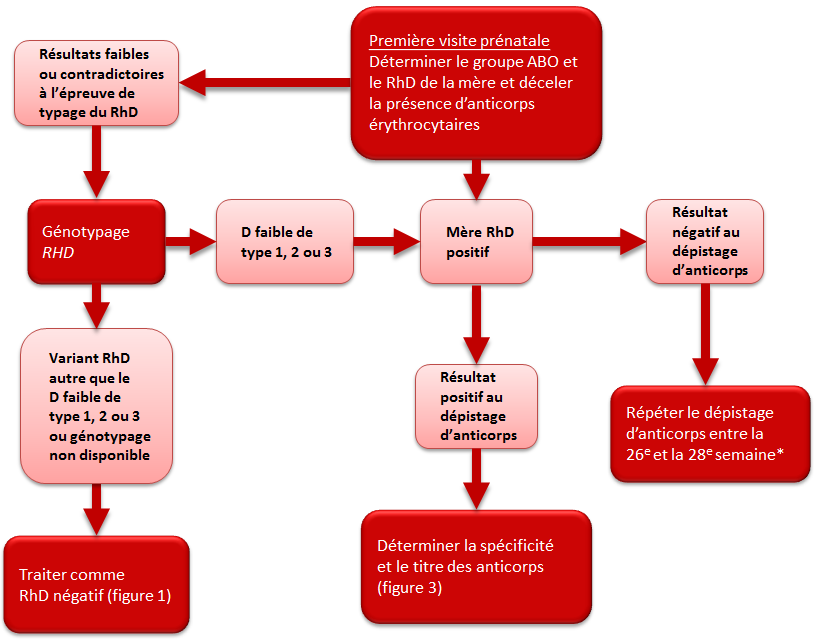
Figure 2. Épreuves sérologiques prénatales chez une mère RhD positif
*Politique recommandée par la Société des obstétriciens et des gynécologues du Canada (SOGC)2 et le British Committee for Standards in Heamatology1
Identification des variants RhD
Certaines femmes peuvent obtenir des résultats faibles ou contradictoires à l’épreuve de typage du RhD, ou les résultats peuvent différer des résultats antérieurs. La cause la plus courante d’un variant RhD est le remplacement d’un seul nucléotide dans un allèle RHD, mais d’autres mécanismes génétiques peuvent intervenir. Un type courant de variant RhD est le phénotype D faible. Les femmes porteuses de ce phénotype expriment faiblement l’antigène RhD et peuvent obtenir un typage RhD variable selon les antisérums ou la méthode de dépistage employés au laboratoire. Un autre type de variant RhD est le phénotype D partiel dans lequel l’antigène RhD est altéré, ce qui pourrait permettre à une personne de produire des alloanticorps dirigés contre les épitopes sur les globules rouges RhD positif différents des leurs. La plupart des femmes ayant un phénotype D faible ou partiel présentent un faible risque de produire des anticorps anti-D. Selon la plupart des lignes directrices et des opinions publiées, il n’est pas recommandé de soumettre les femmes enceintes au test de dépistage sérologique de l’antigène D faible (phase à l’antiglobuline). De même, la plupart des normes de pratique transfusionnelle (AABB,4 CSA5 et SCMT6) n’exigent pas ce test chez les femmes pendant la grossesse. Conformément à ces recommandations, les laboratoires d’analyses périnatales de la Société canadienne du sang ne procèdent pas à ce test pour les femmes enceintes RhD négatif2.
En 2015, un groupe de travail conjoint d’AABB et de l’American College of Pathologists a formulé des recommandations concernant le génotypage des femmes enceintes7. L’algorithme proposé reposait sur les résultats de tests effectués de manière manuelle ou automatisée. Si les résultats suggèrent que la patiente possède un phénotype RhD faible ou si les tests donnent des résultats contradictoires, on procède à un génotypage. On jugeait que les femmes ayant un antigène D faible de type 1, 2 ou 3 ne présentaient aucun risque d’allo-immunisation et, par conséquent, qu’elles n’avaient pas besoin d’un traitement préventif par IgRh. Comme les antigènes D faibles de type 1, 2 et 3 comprennent la majorité des variants RhD faibles en Amérique du Nord, on éviterait d’administrer inutilement un produit sanguin (IgRh) à un grand sous-groupe de femmes enceintes. Les autres femmes RhD négatif ou porteuses d’un allèle RHD différent doivent être considérées comme RhD négatif et à risque d’allo-immunisation pour les besoins du traitement préventif par IgRh. Selon une étude canadienne portant sur des femmes enceintes, 0,4 % des femmes RhD négatif selon les résultats du test sérologique présentaient un typage RhD sérologique variable8. Parmi elles, 61 % étaient considérées, par suite du génotypage RHD, comme ayant un antigène D faible de type 1, 2 ou 3; on pouvait donc, en toute sécurité, leur attribuer un RhD positif. Elles étaient dès lors non admissibles à un traitement préventif par IgRh8. Si l’on ne peut effectuer le génotypage RHD, il est recommandé de considérer les femmes présentant une réactivité sérologique variable comme étant RhD négatif et admissibles au traitement préventif par IgRh afin d’éviter la production d’anticorps anti-D et de réduire le risque de maladie hémolytique du fœtus et du nouveau-né. Le Comité consultatif national sur le sang et les produits sanguins recommande de soumettre à un génotypage RHD les femmes enceintes ayant obtenu des résultats contradictoires, faibles ou non concluants au test sérologique de RhD afin de déterminer la pertinence de l’administration d’IgRh et de préciser le type optimal de Rh à transfuser9.
Dans de nombreux autres pays, on réalise un dépistage prénatal non invasif (DPNI) sur un échantillon de sang prélevé sur les femmes enceintes RhD négatif. Ce dépistage permet de prédire le phénotype RhD du fœtus en fonction du génotypage de son ADN dans le plasma maternel. Ainsi, il est possible d’administrer le traitement préventif par IgRh uniquement aux femmes RhD négatif dont le fœtus est RhD positif. Grâce à cette approche ciblée, on évite d’administrer des IgRh à environ un tiers des femmes RhD négatif du fait que leur fœtus est RhD négatif10.
Traitement préventif par IgRh pour la prise en charge de femmes RhD négatif non sensibilisées
Pendant la période prénatale, on traite par IgRh les femmes RhD négatif ne présentant aucun niveau décelable d’anticorps anti-D (non sensibilisées) afin de prévenir l’allo-immunisation et de réduire le risque de maladie hémolytique du fœtus et du nouveau-né. Signalons que chez les patientes ayant été traitées auparavant par IgRh, les anticorps anti-D passifs persistent pendant de nombreuses semaines. Il faut en tenir compte avant de renoncer à un traitement préventif de routine par IgRh. Les doses d’IgRh recommandées sont indiquées au tableau 2. Les IgRh contiennent des protéines plasmatiques et sont principalement composées d’immunoglobulines G (IgG) anti-D. Elles sont préparées au moyen de mélanges de plasma humain provenant de plusieurs donneurs présentant une forte concentration d’anticorps anti-D. Pour des précisions sur les indications, les contre-indications, l’administration et le stockage des IgRh, se reporter au chapitre 4 du présent guide.
Le mécanisme d’action des IgRh n’a pas été clairement établi, mais leurs bienfaits sont bien documentés11, 12. L’administration des IgRh au cours des 72 heures suivant l’accouchement à terme d’un nourrisson RhD positif par une mère RhD négatif ramène l’incidence de l’allo-immunisation de 12 ou 13 % à 1 ou 2 %. Quand on administre les IgRh à la 28e semaine de grossesse, en plus d’une dose postnatale, l’incidence de l’allo-immunisation chute à 0,1 %. Une dose de 1 500 UI (300 µg) d’IgRh confère une protection contre l’immunisation par 15 ml de globules rouges RhD positif (ou 30 ml de sang total).
Lorsqu’on connaît avec certitude l’identité du père de l’enfant, on peut offrir de déterminer son groupage RhD. Si l’on est certain de la paternité et que le père du bébé est RhD négatif, le médecin peut choisir, en concertation avec la patiente, de ne pas administrer d’IgRh afin d’éviter une exposition inutile à un produit sanguin. Dans certains cas, on peut effectuer le phénotypage RHD du fœtus à partir de prélèvements de sang maternel, d’amniocytes ou de villosités choriales. Si l’on établit que le fœtus est RhD négatif, il est possible de renoncer à l’administration d’IgRh.
Tableau 2 : Doses d’IgRh recommandées pour les femmes RhD négatif n’ayant pas d’anticorps anti-D pendant la grossesse+ ∞
| Indication | Dose d’IgRh @ |
|---|---|
| Grossesse (à la 28e semaine)#$ | 300 µg (1 500 UI) par voie IV ou IM |
| Postpartum, si le nouveau-né est RhD positif, y compris s’il exprime faiblement l’antigène D* (dans les 72 heures suivant la naissance) |
120 µg (600 UI) par voie IV ou IM ou 300 µg (1 500 UI) par voie IV ou IM |
| Risque d’avortement spontané§ | 300 µg (1 500 UI) par voie IV ou IM |
| Avortement (notamment une fausse couche tout au début de la grossesse), amniocentèse ou prélèvement de villosités choriales après 12 semaines de grossesse# | 300 µg (1 500 UI) par voie IV ou IM |
| Avortement, amniocentèse ou toute autre manipulation à 12 semaines ou moins de grossesse# |
120 µg (600 UI) par voie IV ou IM |
| Autres indications† | 300 µg (1 500 UI) par voie IV ou IM‡ |
|
+Lorsqu’on connaît avec certitude l’identité du père de l’enfant, il est possible de proposer à une femme RhD négatif de déterminer le RhD du père. Si le père est RhD négatif, on peut ne pas administrer le traitement préventif par IgRh.
∞ Si l’on sait que le fœtus ou le nouveau-né est RhD négatif, à moins qu’il n’exprime faiblement l’antigène D, le traitement préventif par IgRh n’est pas nécessaire.
# On doit envisager de répéter la dose d’IgRh avant la naissance si la période sans traitement préventif par IgRh dépasse 12 semaines ou que la dose administrée est inférieure à 1 500 UI.
$ Ou 120 µg (600 UI) d’IgRh peuvent être administrés à la 28e et à la 34e semaine de grossesse.
* Il faut procéder à des épreuves pour quantifier l’hémorragie fœto-maternelle. Une dose supplémentaire d’IgRh sera nécessaire si l’on détermine que l’hémorragie transplacentaire fœto-maternelle représente plus de 12 ml de sang fœtal (6 ml de globules rouges fœtaux) pour la dose de 600 UI, ou plus de 30 ml de sang fœtal (15 ml de globules rouges fœtaux) pour celle de 1 500 UI.
§ Le traitement par IgRh ne sera peut-être pas nécessaire en cas de risque d’avortement spontané, si le fœtus est viable et que le saignement cesse avant 12 semaines de grossesse. Il est recommandé après une grossesse ectopique ou molaire, ou en cas d’interruption thérapeutique d’une grossesse, peu importe l’âge gestationnel.
† Les autres indications comprennent tout incident susceptible d’entraîner l’introduction de cellules fœtales dans le sang de la mère à n’importe quel stade de la grossesse. On songe notamment ici à une version, à un traumatisme abdominal, à une grossesse ectopique et à une mort fœtale in utero ainsi qu’au recours à une épargne cellulaire peropératoire pendant une césarienne lorsqu’on ne connaît pas le RhD du fœtus.
@ Le dosage des IgRh peut varier selon la politique locale et la notice du produit. Signalons que les formulations ne conviennent pas toutes à l’administration par voie IV. Le produit WinRho, distribué par la Société canadienne du sang, peut être administré par voie IV ou IM.
Tableau inspiré des recommandations de 2018 de la Société des obstétriciens et gynécologues du Canada2, de la notice des produits13 et de Qureshi et coll.14 |
|
Une dose de 300 µg (1 500 UI) d’IgRh doit être administrée systématiquement à toutes les femmes RhD négatif non sensibilisées à la 28e semaine de grossesse, aux femmes ayant un variant RhD autre qu’un antigène D faible de type 1, 2 ou 3 identifié par génotypage, ainsi qu’à celles dont les résultats aux tests sérologiques ne sont pas uniformes et pour lesquelles le génotypage n’est pas possible. On doit aussi administrer des IgRh à toutes les femmes RhD négatif n’ayant pas d’anticorps après tout incident susceptible d’entraîner l’introduction de cellules fœtales dans le sang de la mère. On songe notamment à un avortement, à un risque d’avortement spontané, à une amniocentèse, au prélèvement de villosités choriales, à une version, à un traumatisme abdominal, à une grossesse ectopique ou molaire et à une mort fœtale in utero. Le recours à une épargne cellulaire peropératoire pendant la césarienne d’une femme RhD négatif n’ayant pas d’anticorps doit également s’accompagner d’un traitement préventif par IgRh. Si la dose prénatale d’IgRh est administrée avant la 28e semaine de grossesse, il faudra envisager de répéter l’administration avant la naissance si la période sans traitement préventif par IgRh dépasse 12 semaines.
Dans les 72 heures suivant l’accouchement d’un enfant RhD positif, toutes les mères RhD négatif doivent recevoir 120 µg (600 UI) ou 300 µg (1 500 UI) d’IgRh. Les femmes ayant un variant RhD d’un type autre que l’antigène D faible de type 1, 2 ou 3 et celles dont les résultats aux tests sérologiques ne sont pas uniformes et pour lesquelles les résultats du génotypage ne sont pas connus doivent également recevoir un traitement préventif par IgRh. Le dosage peut varier selon les cas cliniques; on peut le déterminer en consultant la notice du produit ainsi que les politiques locales. La prescription de la plus faible dose d’IgRh accroît la possibilité d’avoir à en donner d’autres après la confirmation d’une hémorragie fœto-maternelle. Un test systématique pour ce type d’hémorragie s’impose pour toutes les femmes RhD négatif qui accouchent d’un bébé RhD positif ou de RhD inconnu (normes de la CSA5 et de la SCMT*6). Si un test de dépistage semi-quantitatif (test de rosette) est positif, on effectue le test de coloration de Kleihauer-Betke ou une cytométrie de flux afin de quantifier le volume de l’hémorragie et de déterminer la dose d’IgRh à administrer (normes de la CSA5 et de la SCMT6). Si le volume de l’hémorragie dépasse la capacité protectrice des IgRh conférée par le premier traitement, il faudra en administrer une dose supplémentaire. Cela est particulièrement important si la dose la plus faible, 120 µg (600 UI) d’IgRh, a été administrée et, dans tous les cas, le traitement doit inclure la recommandation d’évaluer la nécessité d’administrer ou non une ou des doses supplémentaires. Si aucune dose d’IgRh n’a été administrée au cours des 72 heures suivant l’accouchement, il faudra le faire dès qu’on en constate le besoin, et ce, jusqu’au 28e jour après l’accouchement2.
Prise en charge des femmes présentant des anticorps érythrocytaires
Identification des anticorps
On doit déterminer la spécificité des anticorps érythrocytaires chez toutes les femmes (Rh[D] négatif ou positif) ayant obtenu un résultat positif à un test de dépistage de ces anticorps (figure 3). Si l’anticorps est susceptible de causer la maladie hémolytique du fœtus et du nouveau-né (tableau 3), on doit soumettre le père à des analyses pour déterminer s’il exprime l’antigène ou les antigènes correspondants. Si l’on est certain de l’identité du père et que ses résultats sont négatifs pour l’antigène ou les antigènes, le fœtus n’est pas jugé à risque. Si le père exprime l’antigène ou les antigènes correspondants, il est possible que le fœtus les exprime également, et le risque de maladie hémolytique du fœtus et du nouveau-né est réel. Lorsqu’il existe un risque de maladie hémolytique du fœtus et du nouveau-né, il est recommandé de consulter un obstétricien d’expérience en début de grossesse au sujet du plan de traitement. De plus, la mère devrait être dirigée vers un spécialiste compétent à des fins d’évaluation et de prise en charge. S’il est possible d’effectuer une transfusion à la mère, au fœtus ou au nouveau-né, il faut consulter un spécialiste en médecine transfusionnelle dès que possible pendant la grossesse. L’accouchement devrait préférablement avoir lieu dans un lieu pourvu d’installations de soins intensifs néonatals.
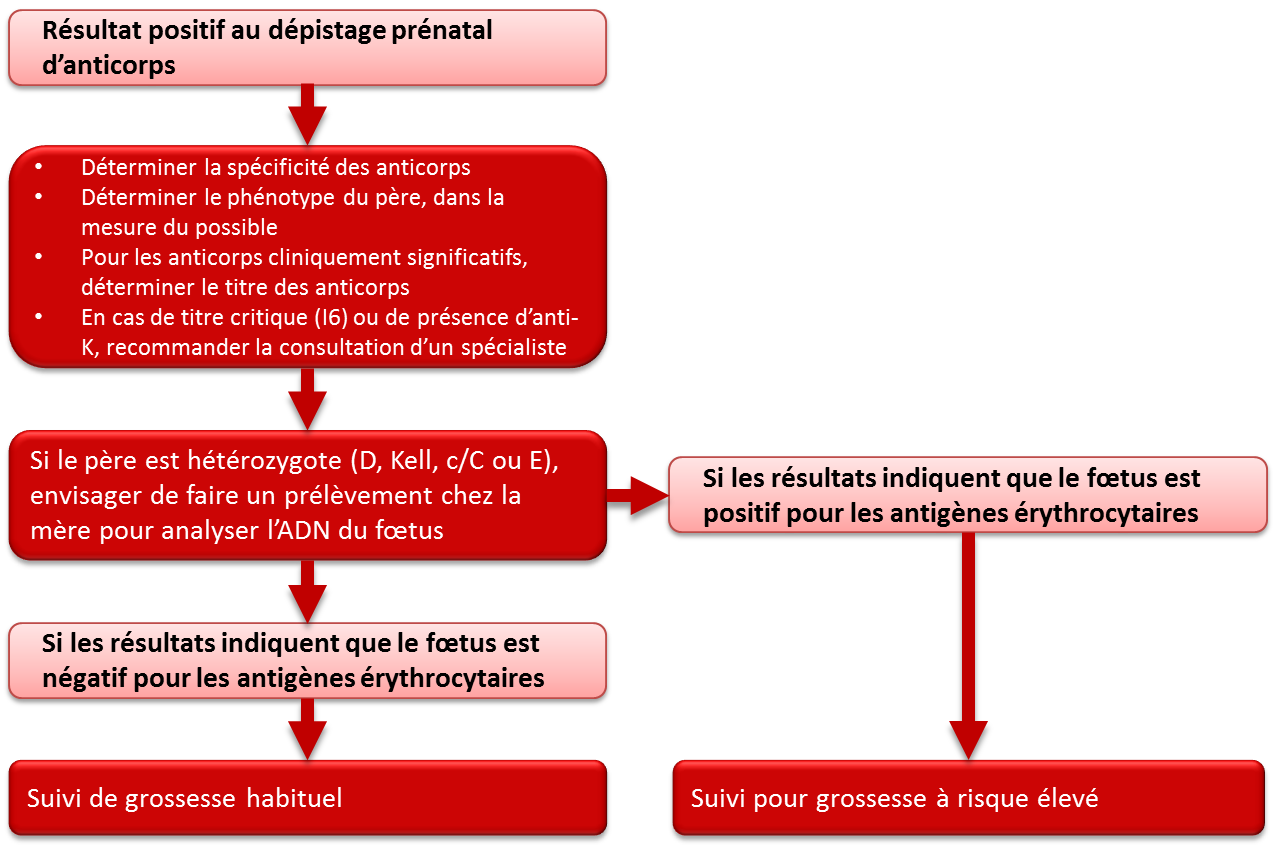
Tableau 3 : Anticorps érythrocytaires fréquents pouvant être associés à la maladie hémolytique du fœtus et du nouveau-né (MHFN)*
| Indication | Système de groupe sanguin | Spécificité antigénique |
|---|---|---|
| Anticorps associés à une forme grave de la MHFN | Rhésus | D, C, c, E |
| Kell | K, k | |
| Duffy | Fya | |
| Kidd | Jka, Jkb | |
| MNS | M§, S | |
| Anticorps associés à une forme légère de la MHFN | ABO | A, B |
| li | i | |
| Duffy | Fyb | |
| Lutheran | Lua, Lub | |
| Anticorps non associés à la MHFN | Lewis | Lea, Leb |
| li | l | |
| P | P | |
|
*Cette liste non exhaustive se limite aux anticorps érythrocytaires les plus fréquents. Pour connaître les anticorps plus rares, consulter Issit et Anstee15.
§ L’anti-M, cliniquement significatif uniquement en présence d’anticorps IgG, peut causer une anémie néonatale tardive. Pour des précisions sur l’anti-M, se reporter à l’article sur l’anti-M, dans la section « Bonnes pratiques » du site du Développement professionnel de la Société canadienne du sang. |
||
Génotypage du groupe sanguin du fœtus
En cas de grossesse compliquée par un ou des anticorps qui constituent une cause connue de la maladie hémolytique du fœtus et du nouveau-né (tableau 3) et lorsque le père est hétérozygote pour l’antigène ou les antigènes érythrocytaires en question, ou si l'on ne sait pas si l’antigène ou les antigènes sont présents ou non chez le père, on peut avoir recours au génotypage du fœtus pour déterminer le risque de maladie hémolytique du fœtus et du nouveau-né. Grâce aux techniques actuelles, on peut établir avec grande précision le génotypage de l’ADN du fœtus au moyen d’un échantillon de sang de la mère. Le génotypage des antigènes RhD, E, C et c ainsi que des antigènes Kell peut se faire dans des laboratoires de référence spécialisés. La Société canadienne du sang et plusieurs services de dépistage prénatal en milieu hospitalier au Canada disposent de programmes visant à faciliter le génotypage des fœtus à partir d’un échantillon de sang des mères présentant un titre critique d’anticorps (titre 16) dirigés contre les antigènes Rh et Kell. On peut prédire le phénotype du fœtus d’après les résultats du génotypage. Si les résultats indiquent que le fœtus est négatif pour l’antigène en question, le médecin traitant peut, à sa discrétion, amorcer un suivi de grossesse habituel au lieu d’opter pour les soins obstétriques pour grossesse à risque élevé nécessaires en cas de prédiction d’un fœtus positif pour l’antigène. Dans de rares cas, pour certains antigènes outre les antigènes Rh et Kell, il est possible de réaliser un test sur l’ADN extrait des amniocytes, après une amniocentèse, ou sur l’ADN des villosités choriales, après leur prélèvement. Ces tests doivent aussi être confiés à des laboratoires spécialisés et réalisés uniquement lorsqu’il y a des antécédents de maladie hémolytique du fœtus et du nouveau-né et que la connaissance du type d’antigène fœtal modifierait grandement la nature des soins à donner pendant la grossesse. L’amniocentèse et le prélèvement des villosités choriales sont plus invasifs que le génotypage réalisé sur un échantillon de sang maternel et présentent un risque faible, mais important, pour le fœtus.
Rôle de la pratique transfusionnelle dans la prévention de la maladie hémolytique du fœtus et du nouveau-né
L’allo-immunisation anti-érythrocytaire* pouvant entraîner une maladie hémolytique du fœtus et du nouveau-né est un risque inhérent à la transfusion chez les patientes en âge de procréer. Le meilleur moyen d’éviter ce risque et d’autres complications est de procéder à des transfusions uniquement en cas d’absolue nécessité. Certaines lignes directrices internationales16 recommandent l’utilisation systématique de globules rouges exempts de l’antigène Kell pour les transfusions chez les femmes en âge de procréer. Cette stratégie de prévention, adoptée par des hôpitaux et des régions sanitaires au Canada, s’est avérée efficace et a permis de réduire le taux d’allo-immunisation anti-Kell là où elle est en place depuis longtemps16, 17.
Thrombopénie périnatale
La thrombopénie néonatale peut être causée par une diminution de la production de plaquettes, une consommation accrue de celles-ci, ou par une hémodilution. Il faut également tenir compte des fausses causes préanalytiques, comme les prélèvements coagulés après des procédures de prélèvement sanguin difficiles chez les nouveau-nés. L’augmentation de la consommation de plaquettes est la cause la plus fréquente de la thrombopénie. Elle peut résulter de divers facteurs, dont une septicémie, les effets de médicaments, une entérocolite nécrosante, une coagulation intravasculaire disséminée, une insuffisance placentaire, une infection congénitale ou une asphyxie, mais elle peut aussi être d’origine immunologique.
En général, on classe la thrombopénie néonatale d’origine immunologique selon deux catégories : 1) la thrombopénie fœtale et néonatale allo-immune; 2) la thrombopénie causée par un purpura thrombopénique immunologique maternel. Le purpura thrombopénique immunologique maternel est très rarement la cause de la thrombopénie chez les nouveau-nés.
Thrombopénie fœtale et néonatale allo-immune
La thrombopénie fœtale et néonatale allo-immune survient lorsque les plaquettes du fœtus expriment un antigène paternel qui est absent sur les plaquettes de la mère. Les plaquettes fœtales peuvent pénétrer dans la circulation sanguine de la mère durant la grossesse ou l’accouchement. Si la mère devient allo-immunisée, ses alloanticorps IgG peuvent traverser le placenta et provoquer une thrombopénie chez le fœtus. La thrombopénie se résorbe spontanément et disparaît d’ordinaire au cours des deux à trois semaines après l’accouchement. La gravité de la thrombopénie fœtale et néonatale allo-immune est variable : elle va de la thrombopénie légère à la thrombopénie grave avec hémorragie, se produisant parfois in utero.
Analyses sérologiques : Si l’on soupçonne une thrombopénie fœtale et néonatale allo-immune chez un nourrisson, il est recommandé de soumettre les parents à des tests sérologiques, dont un génotypage des gènes déterminant les antigènes plaquettaires humains (HPA) associés à cette affection. En outre, il est recommandé d’effectuer le dépistage, chez la mère, d’anticorps antiplaquettaires spécifiques en vue de poser un diagnostic. Il est aussi recommandé de procéder, dans la mesure du possible, au génotypage d’un échantillon du sang du nourrisson afin d’identifier les gènes HPA en question. L’anticorps HPA le plus fréquent, le HPA-1a, est à l’origine d’environ 90 % des cas de thrombopénie fœtale et néonatale allo-immune chez les personnes de race blanche. Dans ces cas, la mère est généralement homozygote HPA-1b et développe des anticorps anti-HPA-1a qui traversent le placenta et se lient aux antigènes HPA-1a sur les plaquettes du fœtus. Les anticorps anti-HPA-5b et anti-HPA-3a sont parmi les autres anticorps susceptibles de causer cette pathologie.
Traitement d’un nourrisson atteint : Un nourrisson atteint d’une thrombopénie fœtale et néonatale allo-immune qui a besoin d’une transfusion de plaquettes doit recevoir, dans la mesure du possible, des plaquettes dépourvues de l’antigène HPA. La Société canadienne du sang tient un registre des donneurs de plaquettes d’aphérèse ayant des génotypes HPA particuliers. Il est donc possible de demander des plaquettes allogéniques ayant un type de HPA précis. Comme thérapie initiale, on peut utiliser des mélanges de plaquettes provenant de donneurs allogéniques, jusqu’à l’obtention de plaquettes négatives pour les HPA; ils permettent souvent de faire augmenter le nombre de plaquettes, même en présence d’anticorps anti-HPA18. Dans de rares cas, on peut utiliser les plaquettes de la mère comme source de plaquettes négatives pour les HPA. Il faut alors extraire le plasma maternel et remettre les plaquettes en suspension dans du plasma provenant du donneur ou dans une solution saline. Comme le HLA de la mère biologique détermine en partie l’haplotype du fœtus, il est crucial d’irradier les plaquettes avant la transfusion afin de prévenir une réaction du greffon contre l’hôte post-transfusionnelle. (Pour plus de précisions, se reporter au chapitre 10, Les réactions transfusionnelles.) Même si les plaquettes de la mère sont négatives pour l’antigène en question, elles sont rarement utilisées en raison des obstacles logistiques au prélèvement et au traitement des plaquettes d’une femme dans la période périnatale. L’administration d’immunoglobulines par voie intraveineuse (igIV), à raison de 1 g/kg/j pendant un maximum de deux jours, peut être efficace et envisagée si les transfusions de plaquettes ne permettent pas d’augmenter le nombre de plaquettes ou qu’on ne dispose pas de plaquettes. Pour des précisions sur l’utilisation des immunoglobulines, se reporter au chapitre 4 du présent guide.
Grossesses ultérieures : Les femmes enceintes qui ont déjà accouché d’un enfant atteint d’une thrombopénie fœtale et néonatale allo-immune doivent être suivies par un médecin ayant de l’expérience dans le traitement de ce type de trouble plaquettaire. Le groupe International Collaboration for Transfusion Medicine Guidelines19 élabore actuellement des lignes directrices concernant la pratique fondée sur des données probantes pour la thrombopénie fœtale et néonatale allo-immune. Selon les résultats d’un examen systématique dirigé par ce groupe, le principal traitement prénatal en cas de thrombopénie fœtale et néonatale allo-immune consisterait à administrer des IgIV (1g/kg), avec ou sans l’ajout de corticostéroïdes20, 21. La Société canadienne du sang peut demander le prélèvement de plaquettes par aphérèse auprès d’un donneur négatif pour les HPA avant l’accouchement.
Purpura thrombopénique immunologique maternel
Le nourrisson né d’une mère atteinte d’un purpura thrombopénique immunologique peut présenter une thrombopénie due au transfert passif d’auto-anticorps à travers le placenta. Chez la plupart des nourrissons, la thrombopénie est légère et le risque d’hémorragie est très faible. Les hémorragies intracrâniennes sont rarissimes.
Les nourrissons présentant une thrombopénie causée par un purpura thrombopénique immunologique maternel ont rarement besoin d’un traitement. Lorsqu’une transfusion de plaquettes est nécessaire, on recommande d’utiliser des produits plaquettaires allogéniques correspondant au groupe sanguin. La perfusion d’immunoglobulines et l’administration de corticostéroïdes figurent parmi les autres traitements qui ont été utilisés dans les cas graves. Pour des précisions sur les immunoglobulines, se reporter au chapitre 4 du présent guide.
Crédits de développement professionnel continu
Les associés et les professionnels de la santé qui participent au Programme de maintien du certificat du Collège royal des médecins et chirurgiens du Canada peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue comme activité de développement professionnel continu au titre de la Section 2 — Apprentissage individuel. Ces personnes peuvent réclamer 0,5 crédit par heure de lecture, jusqu’à hauteur de 30 crédits par année.
Les technologistes médicaux qui participent au Programme d’enrichissement professionnel (PEP) de la Société canadienne de science de laboratoire médical peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue en tant qu’activité non vérifiée.
Remerciements
Les auteures, Judith Hannon et Gwen Clarke, remercient Kathryn Webert, M.D., FRCPC, et Heather Hume, M.D., FRCPC, qui ont rédigé la version précédente du présent chapitre, ainsi que Lani Lieberman, M.D., FRCPC, qui a passé en revue la version actuelle.
Si vous avez des questions ou des suggestions d’amélioration concernant le Guide de la pratique transfusionnelle, veuillez communiquer avec nous par l’entremise de notre formulaire.
Documents de référence
- White J, Qureshi H, Massey E, Needs M, Byrne G, Daniels G, Allard S. Guideline for blood grouping and red cell antibody testing in pregnancy. Transfus Med 2016; 26: 246-63.
- Fung KFK, Eason E. No. 133-Prevention of Rh Alloimmunization. Journal of Obstetrics and Gynaecology Canada 2018; 40: e1-e10.
- Judd WJ, for the Scientific Section Coordinating Committee. Guidelines for Prenatal and Perinatal Immunohematology. Published by AABB, 2005.
- Standards Program Committee (SPC), Blood Banks/Transfusion Services Standards Program Unit (BBTS SPU). Chapter 5: Process Control; Section 5.30: Transfusion-Service-Related Activities: Rh Immune Globulin. In Standards for Blood banks and Transfusion services, 29th edition. Published by AABB, 2014.
- CSA Group. CAN/CSA-Z902-15 Blood and Blood Components. Published in Canada by CSA, 2015.
- CSTM Standards Committee. Standards for Hospital Transfusion Services, Version 4. Published in Markham, Canada by Canadian Society for Transfusion Medicine, 2017.
- Sandler SG, Flegel WA, Westhoff CM, Denomme GA, Delaney M, Keller MA, Johnson ST, Katz L, Queenan JT, Vassallo RR, Simon CD. It's time to phase in RHD genotyping for patients with a serologic weak D phenotype. College of American Pathologists Transfusion Medicine Resource Committee Work Group. Transfusion 2015; 55: 680-9.
- Clarke G, Hannon J, Berardi P, Barr G, Cote J, Fallis R, Alport T, Lane D, Petraszko T, Ochoa G, Goldman M. Resolving variable maternal D typing using serology and genotyping in selected prenatal patients. Transfusion 2016; 56: 2980-5.
- National Advisory Committee on Blood and Blood Products. RHD Genotyping for Prenatal Patients with a Serologically Weak D Phenotype. 2017.
- van der Schoot CE, de Haas M, Clausen FB. Genotyping to prevent Rh disease: has the time come? Curr Opin Hematol 2017; 24: 544-50.
- Bowman J. Thirty-five years of Rh prophylaxis. Transfusion 2003; 43: 1661-6.
- Bowman J. Rh-immunoglobulin: Rh prophylaxis. Best Pract Res Clin Haematol 2006; 19: 27-34.
- Win-Rho SDF [Rho(D) Immune Globulin (Human) for Injection] package insert. Published in Winnipeg, Canada by Cangene Corporation, August 2001.
- Qureshi H, Massey E, Kirwan D, Davies T, Robson S, White J, Jones J, Allard S. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med 2014; 24: 8-20.
- Issitt PD, Anstee DJ. Applied Blood Group Serology. Published in Durham (N.C.) by Montgomery Scientific Publications, 1998.
- Solheim BG. Provision of K- (KEL1-) blood to women not more than 50 years of age. Transfusion 2015; 55: 468-9.
- Kamphuis MM, Lindenburg I, van Kamp IL, Meerman RH, Kanhai HH, Oepkes D. Implementation of routine screening for Kell antibodies: does it improve perinatal survival? Transfusion 2008; 48: 953-7.
- Bakchoul T, Bassler D, Heckmann M, Thiele T, Kiefel V, Gross I, Arnold DM, DiTomasso J, Smith JW, Paes B, Greinacher A. Management of infants born with severe neonatal alloimmune thrombocytopenia: the role of platelet transfusions and intravenous immunoglobulin. Transfusion 2014; 54: 640-5.
- International Collaboration for Transfusion Medicine Guidelines. Clinical Guidelines and Systematic Reviews. https://www.ictmg.org (Last accessed 2018/04/24).
- Winkelhorst D, Murphy MF, Greinacher A, Shehata N, Bakchoul T, Massey E, Baker J, Lieberman L, Tanael S, Hume H, Arnold DM, Baidya S, Bertrand G, Bussel J, Kjaer M, Kaplan C, Kjeldsen-Kragh J, Oepkes D, Ryan G. Antenatal management in fetal and neonatal alloimmune thrombocytopenia: a systematic review. Blood 2017; 129: 1538-47.
- Bertrand G, Kaplan C. How do we treat fetal and neonatal alloimmune thrombocytopenia? Transfusion 2014; 54: 1698-703.