Déclaration des réactions transfusionnelles indésirables
Auteur : Matthew Yan, MD, FRCPC
Publication : Janvier 2020
Public cible : Professionnels de la santé travaillant en milieu hospitalier au Canada (sauf au Québec)
Le présent guide, destiné aux établissements hospitaliers canadiens (sauf au Québec), explique les procédures de déclaration des réactions transfusionnelles indésirables. Pour en savoir plus sur le diagnostic, la classification et la prise en charge des réactions transfusionnelles, veuillez vous reporter au chapitre 10 du Guide de la pratique transfusionnelle de la Société canadienne du sang et au guide de l’utilisateur du Système de surveillance des incidents transfusionnels (SSIT). Le présent guide ne traite pas du signalement des accidents et manquements. Pour plus d’informations à ce sujet, veuillez vous reporter aux articles 103 à 108 du Règlement sur le sang.
Déclaration provinciale
Veuillez vous référer aux politiques provinciales en la matière. Bien que des pratiques similaires puissent exister à l’échelle nationale, il peut y avoir de petites différences dans chaque province (p. ex. déclaration des réactions mineures, telles que les réactions fébriles non hémolytiques, et utilisation de formulaires différents).
Vous trouverez ci-dessous les liens vers les sections appropriées des sites Web des bureaux provinciaux de coordination des produits sanguins :
- BC Provincial Blood Coordinating Office
- Alberta Provincial Blood Coordinating Program
- Saskatchewan Provincial Blood Coordinating Office
- Best Blood Manitoba
- Réseau régional ontarien de coordination du sang
- Newfoundland and Labrador Provincial Blood Coordinating Program
- Nova Scotia Provincial Blood Coordinating Program
Système national d’hémovigilance
En réponse au rapport de la Commission d’enquête sur l’approvisionnement en sang au Canada déposé par le Juge Krever, en 1997, plusieurs mesures ont été prises dans le but de mieux surveiller le système d’approvisionnement au Canada. Lancé en 2001 par le Centre de la lutte contre les maladies transmissibles et les infections et l’Agence de la santé publique du Canada, le Système de surveillance des incidents transfusionnels (SSIT), est un système pancanadien qui enregistre les réactions indésirables liées à la transfusion de composants sanguins (globules rouges, plaquettes, plasma) et de protéines plasmatiques et de produits connexes. Bien que les déclarations au SSIT soient volontaires à l’échelle nationale — mais obligatoires dans certaines provinces — entre 80 et 100 établissements hospitaliers y participent.
Composants sanguins
Outre la déclaration volontaire au SSIT, les hôpitaux ou les fabricants de produits pharmaceutiques doivent signaler tout effet indésirable ou effet indésirable grave survenus à la suite d’une transfusion à Santé Canada, conformément au Règlement sur le sang, si ceux-ci présentent un risque pour les patients ou si l’innocuité du composant sanguin utilisé est mise en cause. Pour savoir quelles réactions sont susceptibles de présenter de tels risques, veuillez vous référer au scénario présenté ci-après (figure 1).
Si les pratiques réglementées de la banque de sang sont en cause, les réactions doivent être signalées au Programme Canada Vigilance de Santé Canada; si ce sont les pratiques réglementées du fabricant — Société canadienne du sang ou Héma-Québec — qui sont en cause, elles doivent être signalées au fabricant de façon à ce que celui-ci puisse investiguer et faire un rapport au Programme Canada Vigilance.
Protéines plasmatiques et produits connexes
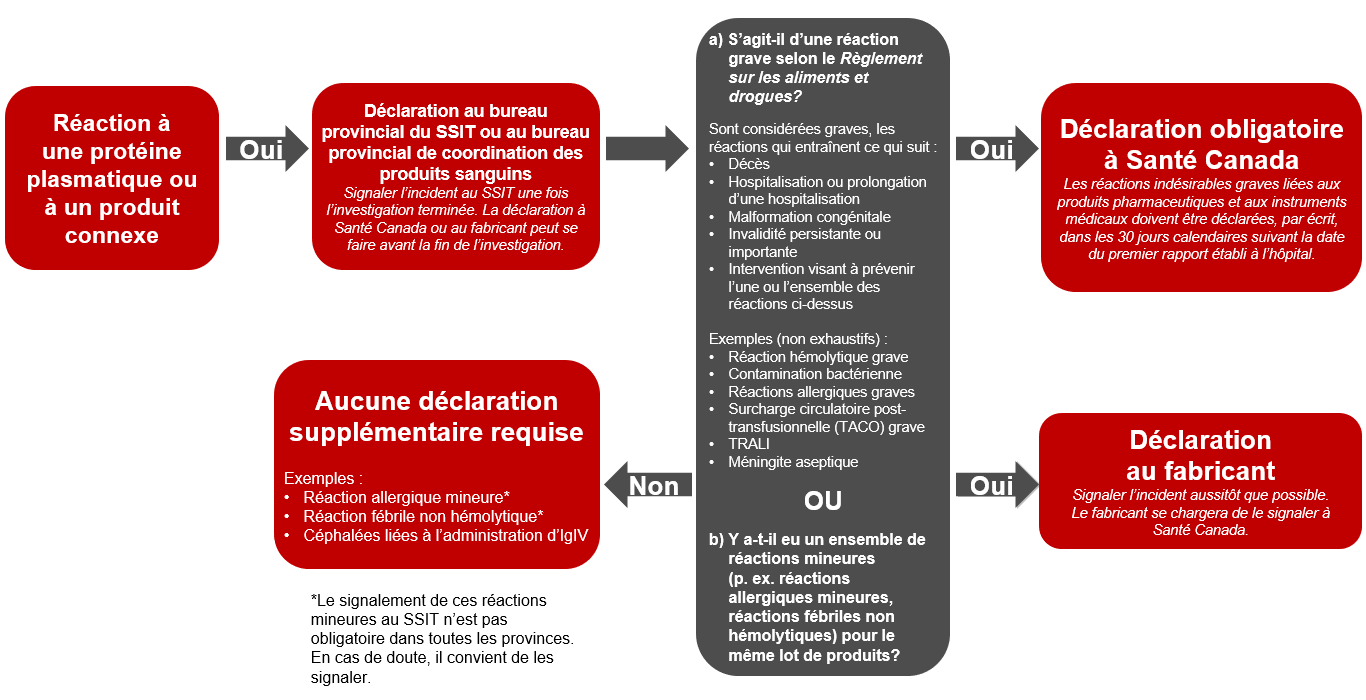
Le terme « protéines plasmatiques et produits connexes » désigne les produits de fractionnement, les produits recombinants, et les spécialités pharmaceutiques, comme l’émicizumab, offerts par la Société canadienne du sang. Outre la déclaration volontaire au SSIT, les hôpitaux doivent signaler toute réaction indésirable grave associée à l’administration de protéines plasmatiques et de produits connexes au Programme Canada Vigilance de Santé Canada, conformément au Règlement sur les aliments et drogues et à la Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa), amendement à la Loi sur les aliments et drogues entré en vigueur le 16 décembre 2019. Il est également recommandé d’en informer le fabricant. Pour plus d’informations sur la déclaration des réactions indésirables associées aux protéines plasmatiques et aux produits connexes, veuillez vous référer au scénario présenté ci-après (figure 2).
La déclaration des réactions transfusionnelles indésirables pouvant paraître confuse étant donné les différentes procédures à suivre et le nombre de parties intéressées, vous trouverez ci-dessous un guide pour vous aider dans vos démarches. En règle générale, il vaut mieux signaler une réaction si l’on a le moindre doute.
Pourquoi déclarer les réactions transfusionnelles indésirables?
Il est important que les services transfusionnels des hôpitaux signalent les réactions indésirables survenues à la suite de transfusions, car cela peut :
- nécessiter le rappel des produits issus d’un même donneur;
- nécessiter la notification du donneur, la réalisation d’une enquête et l’exclusion du donneur du don de sang;
- nécessiter la notification du receveur et la réalisation d’une enquête;
- s’avérer utile aux fins de suivi et de statistiques (p. ex. nouvelle complication ou changement dans la fréquence d’une complication déjà constatée);
- contribuer à une pratique plus sécuritaire de la médecine transfusionnelle.
Comment et à qui déclarer les réactions transfusionnelles indésirables?
- SSIT – Agence de la santé publique du Canada : les réactions doivent être signalées au bureau provincial du SSIT ou au bureau provincial de coordination des produits sanguins, qui transmettront le rapport à l’Agence de la santé publique du Canada. Les hôpitaux des petites provinces, comme l’Île-du-Prince-Édouard, peuvent signaler les réactions à l’Agence de la santé publique du Canada directement.
- Société canadienne du sang : contactez votre centre de distribution.
- Fabricants de protéines plasmatiques et de produits connexes : contactez le fabricant du produit concerné.
- Programme Canada Vigilance de Santé Canada : voir le site Web du programme.
Pour plus d’informations sur les formulaires à utiliser, reportez-vous à la rubrique Formulaires.
Scénarios
Veuillez vous référer aux politiques de votre province en matière de déclaration des réactions transfusionnelles indésirables. Les scénarios ci-dessous sont fournis à titre purement indicatif.
La plupart des réactions transfusionnelles indésirables, voire toutes, doivent être signalées au bureau provincial du SSIT ou au bureau provincial de coordination des produits sanguins. Dans les cas suivants, elles doivent également être signalées à d’autres entités :
- Toute réaction grave ou inattendue à un composant sanguin due à une procédure réglementée doit également être signalée à Santé Canada ou à la Société canadienne du sang, dépendamment de la procédure en cause.
- Toute réaction grave à une protéine plasmatique ou à un produit connexe ou toute série de réactions mineures associées à un même lot de produit doit également être signalée à Santé Canada et au fabricant.
Figure 1 – Déclaration des réactions transfusionnelles indésirables (composants sanguins)
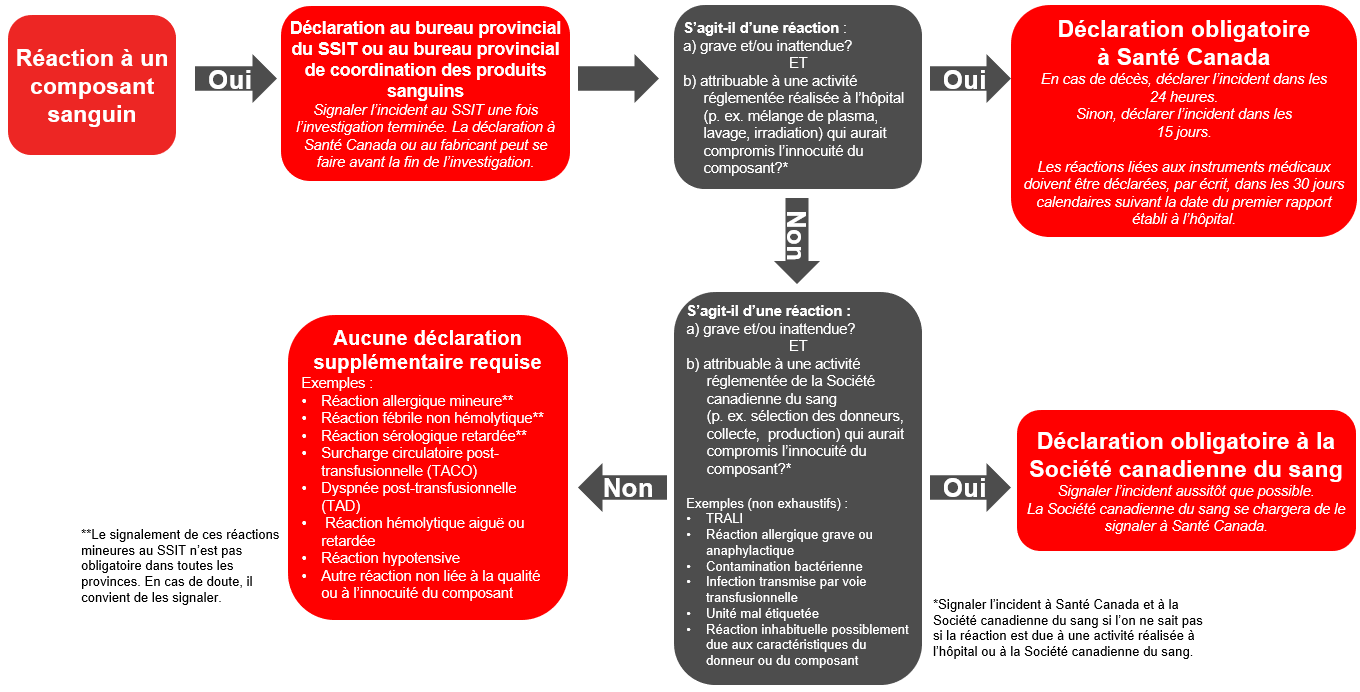
Figure 2 – Déclaration des réactions transfusionnelles indésirables (produits plasmatiques)
Formulaires
Les formulaires à remplir pour le SSIT varient selon l’hôpital et la province. Pour savoir quel formulaire utiliser, veuillez contacter le bureau provincial du SSIT ou le bureau provincial de coordination des produits sanguins. Il existe également un formulaire national, le Formulaire de déclaration des événements indésirables liés aux transfusions au Canada, que vous pouvez utiliser. Les formulaires provinciaux et le formulaire national sont tous acceptés par les fabricants — y compris la Société canadienne du sang — et le Programme Canada Vigilance.
Les réactions graves associées aux protéines plasmatiques et aux produits connexes peuvent également être signalées au Programme Canada Vigilance à l’aide du Formulaire de déclaration des réactions indésirables graves à un médicament à l’intention des hôpitaux. Ce formulaire peut aussi être rempli et soumis en ligne, et permet également de déclarer les réactions indésirables liées aux instruments médicaux.
Pour signaler un cas de TRALI, vous devez remplir le formulaire provincial de déclaration de réactions indésirables ainsi que le formulaire Données sur le patient atteint du TRALI de la Société canadienne du sang.
Pour signaler une infection transmise par voie transfusionnelle (VIH, hépatite virale, etc.) — hormis les cas présumés de contamination bactérienne, vous devez utiliser le formulaire de déclaration de maladie transmissible de la Société canadienne du sang ou contacter votre centre de distribution.
Liens utiles
- Formulaire de déclaration des réactions indésirables graves à un médicament à l'intention des hôpitaux
- Formulaire de déclaration des événements indésirables liés aux transfusions au Canada
- Données sur le patient atteint du TRALI
- Formulaire de déclaration de maladie transmissible
Ressources
- Chapitre 10 – Réactions transfusionnelles (Guide de la pratique transfusionnelle)
- Loi sur les aliments et drogues
- Règlement sur les aliments et drogues (Partie C – Drogues, Titre 1)
- Déclaration obligatoire des réactions indésirables graves à un médicament et des incidents liés aux instruments médicaux par les hôpitaux – Document d’orientation
- Agence de la santé publique du Canada – Système de surveillance des incidents transfusionnels (SSIT)